In Schichtsilikaten sieht auch Helen Hansma von der Universität von Kalifornien in Santa Barbara die Wiege des Lebens Die Idee dafür kam ihr im Urlaub, nachdem sie und ihre Familie in einer alten Mine in Connecticut Glimmer gesammelt hatten. Dieses Mineral aus schichtförmig angeordneten Silikatverbindungen ist sehr weich und für seinen Glanz und seine blättrige Struktur bekannt.
Zuhause tropfte die Forscherin ein paar Tropfen Wasser auf eine Glimmerprobe und besah sie sich unter dem Mikroskop. Dabei bemerkte sie ein paar grünliche, organische Ablagerungen an einigen Kanten des Glimmers. „Ich kam darauf, dass das eigentlich auch ein guter Ort für die Entstehung des Lebens gewesen sein könnte – geschützt in diesen Stapel von Schichten, die sich in Reaktion auf fließendes Wasser auf oder ab bewegten“, erklärt Hansma. „Das wiederum könnte die mechanische Energie geliefert haben, um chemische Bindungen zu erzeugen oder zu brechen.“
Lebensfreundliche Zwischenräume
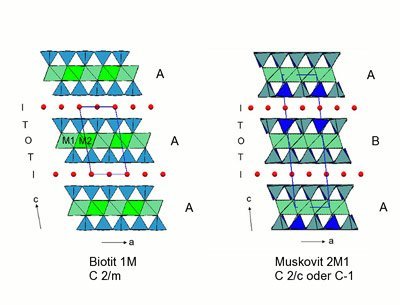
Angeregt durch diese Beobachtungen arbeitete die Forscherin ihre Hypothese aus und führte unter anderem Untersuchungen von „Mica“, wie die Schichtsilikate im englischen Sprachraum bezeichnet werden, mit Hilfe des Rasterkraftmikroskops durch. „Die Mica-Schichten sind so dünn, dass eine Million von ihnen in eine nur einen Millimeter dicke Scheibe Glimmer passen“, erklärt Hansma. „Sie sind anatomisch so flach, dass wir im Rasterkraftmikroskop DNA-Moleküle frei über ihre Oberfläche schwimmen sehen können, ohne sie freipräparieren zu müssen.“
Es zeigte sich, dass die winzigen Zwischenräume der Silikatschichten eine Umgebung bieten, die nicht nur für lebende Zellen, sondern auch für alle Klassen der Biomoleküle, von Proteinen über Nukleinsäuren zu Kohlenhydraten und Fetten, eine geeignete Umgebung bieten. 2010 ging Hansma mit ihrer „Life in the Sheets“-Hypothese an die Öffentlichkeit. Der Kern ihres Szenarios: Zwischen den nur lose aneinander haftenden Schichten des Glimmers bilden sich strukturierte Kompartimente – abgegrenzte Kammern, die den Bausteinen des Lebens das optimale chemische und physikalische Umfeld geboten haben könnten, um sich zu den ersten Zellen zusammenzulagern.
Schutzraum und Energielieferant zugleich
Nach Ansicht der Forscherin sprechen mehrere Faktoren für ein solches Szenario: Die Glimmer-Kammern boten den Biomolekülen Schutz vor Störungen und die Möglichkeit, sich anzureichern. Zudem könnte die Struktur der Kammern als eine Art Blaupause für die Bildung kompartimentierter Lebenseinheiten, den Zellen, geliefert haben. Außerdem spielt das Element Kalium in den Schichtsilikaten eine wichtige Rolle für den Zusammenhalt der Schichten. Sein hoher Gehalt in den Kammern könnte erklären, warum auch die Zellen von Lebewesen so viel Kalium enthalten und für wichtige Stoffwechselprozesse verwenden.
Und schließlich könnten die gegeneinander beweglichen Schichten auch die Energie geliefert haben, um die entscheidenden chemischen Reaktionen auszulösen: Durch den Einfluss von Wellen im Urozean geriet auch der Glimmer in eine Auf- und Abbewegung. Dadurch wurden die Kammern zwischen den Schichten immer wieder verengt, Moleküle aneinander gedrängt oder verschoben. Diese Bewegung könnte die chemische Reaktion der Moleküle miteinander gefördert haben. „Glimmer würde Molekülen genügend Struktur und Schutz bieten, um ihre Entwicklung zu ermöglichen, andererseits aber auch der dynamischen, ständig wandelnden Struktur des Lebens entgegenkommen“, so Hansma.
Besser geeignet als andere Minerale
Hansmas Meinung nach könnte das Schichtsilikat dem entstehenden Leben bessere Bedingungen geboten haben als andere Minerale, die bisher bereits für diese Rolle in Betracht gezogen wurden. Denn während die meisten anderen zwischenzeitlich immer wieder zu nass oder zu trocken geworden sein könnten, fangen die extrem feinen und gut geschützten Kompartimente des Schichtsilikats solche Extreme besser ab. Zudem quellen sie bei Wasseraufnahme nicht auf, wie beispielweise Tonminerale, sondern bleiben stabil.
Aber auch für ihr Szenario gilt: Beweisen lässt sich das alles nicht. Und noch ist zudem nicht geklärt, wie die Biomoleküle den Sprung von der sicheren 2-D-Schablone auf der Mineraloberfläche zur eigenständigen, sich selbst vermehrenden 3-D-Struktur geschafft haben könnten. Denn einmal freigesetzt, wirken an ihnen erneut die verdünnenden und destabilisierenden Kräfte des Urozeans.
Nadja Podbregar
Stand: 25.10.2013