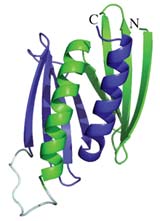
Das erst vor kurzem entdeckte Fragile X Tremor/Ataxie Syndrom (FXTAS) ist eine der häufigsten erblichen neurodegenerativen Krankheiten. Man geht davon aus, dass die Krankheit durch einen Mangel an dem Protein Pur-alpha ausgelöst wird, das für die normale Nervenfunktion unerlässlich ist. Nun ist es Biologen gelungen, die Röntgenkristallstruktur von Pur-alpha zu entschlüsseln.
Wie die Forscher um Dierk Niessing vom Helmholtz Zentrum München und dem Genzentrum der Universität München in der Fachzeitschrift „Proceedings of the National Academy of Sciences“ (PNAS) berichten, haben sie so Einblicke in die molekulare Funktionsweise dieses Proteins gewonnen – und damit Ansatzpunkte für Therapien.
Mutation als Ursache
Bei den meist männlichen FXTAS-Patienten treten die Symptome nach Angaben der Forscher etwa ab dem 55. Lebensjahr auf. Dabei führt das sich fortschreitend verstärkende Nervenleiden zu einem Zittern der Hände und zu Gleichgewichtsstörung sowie Fallneigung beim Gehen (Ataxie). Häufig wird auch eine Beeinträchtigung der kognitiven Fähigkeiten und Demenz beobachtet.
Ursache des FXTAS ist eine Mutation im FMRP-Gen. Diese tritt ungefähr bei einem von 800 Männern auf. Dabei zeigen sich abnorm verlängerte Wiederholungen der Basensequenz CGG: Gesunde Menschen haben fünf bis 54 dieser Wiederholungen, FXTAS-Träger haben 55 bis 200. Bei einer weiteren Verlängerung mit über 200 Wiederholungen tritt schließlich das Fragile X-Syndrom (FXS) auf, das nach dem Down-Syndrom die zweithäufigste Ursache erblicher geistiger Behinderung ist.