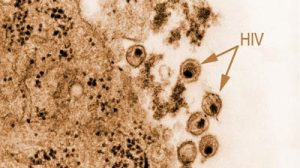
Eine neue Studie könnte möglicherweise erklären, warum nur eine von mehreren unabhängigen Übertragungen von Affen-Immundefizienzviren (SIV) aus Schimpansen auf den Menschen zur weltweiten AIDS-Pandemie führte. Das internationale Forscherteam konnte zeigen, dass es lediglich der HIV-1 Gruppe M (major), die weltweit für mehr als 90 Prozent aller Infektionen verantwortlich ist, gelungen ist, sich nach der Übertragung optimal an den neuen Wirt anzupassen.
{1r}
Nur HIV-1 M entwickelte ein voll funktionsfähiges so genanntes Vpu-Protein im Menschen, so die Wissenschaftler in der Fachzeitschrift „Cell Host & Microbe“. Vpu-Proteine der nichtpandemischen HIV-1 Gruppe O (outlier) und der sehr seltenen Gruppe N (non-M, non-O) dagegen sind entweder nicht in der Lage einen antiviralen Faktor namens Tetherin auszuschalten oder den Transport von CD4, dem primären Rezeptor der HI-Viren, zur Zelloberfläche zu verhindern. Die Forscher hoffen, dass diese Ergebnisse dazu beitragen, neue Wege zu finden, die Ausbreitung der AIDS-Viren zu verhindern.
Zum Schutz gegen retrovirale Infektionen produzieren menschliche Zellen so genannte Restriktionsfaktoren, die die effektive Virusvermehrung blockieren. Einer dieser antiviralen Faktoren wurde erst letztes Jahr von amerikanischen Forschern entdeckt und als Tetherin bezeichnet, weil er neu produzierte Viruspartikel an der Zelloberfläche „festhält“ und dadurch deren weitere Ausbreitung verhindert.