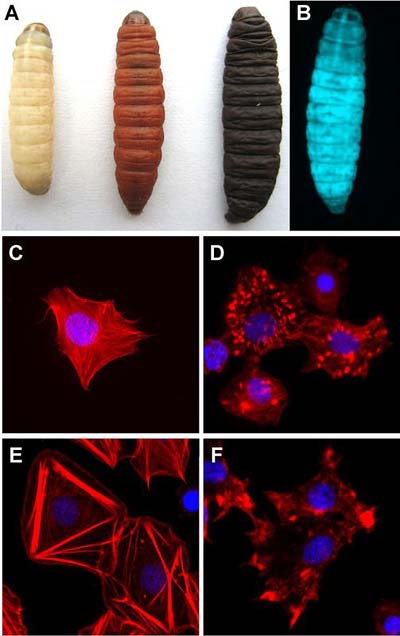
Winzige Würmer dienen der Mikrobe Photorhabdus luminescens als „Taxi“, um in Insektenlarven zu gelangen. Da sie die Larven töten, werden die Nematoden mit den Bakterien auch als Insektizid eingesetzt. So weit so gut. Doch wie die Gifte des Keims genau wirken, war bisher ungeklärt. Doch jetzt ist es Wissenschaftlern gelungen, den Mechanismus der biologischen Insektizide erstmals im Detail zu entschlüsseln.
Danach sind bestimmte Untereinheiten des Toxinkomplexes maßgeblich daran beteiligt, die essenziellen Abwehrreaktionen von Immunzellen zu hemmen. Der gleiche Vorgang wirkt auch bei einigen für Menschen gefährlichen Keimen wie dem Erreger von Lungen- und Beulenpest, schreiben die Forscher um Professor Hans Georg Mannherz von der Ruhr-Universität Bochum (RUB) und dem Max-Planck-Institut für Molekulare Physiologie zusammen mit Kollegen aus Freiburg und den USA in „Science“.
Würmer bringen Bakterien ans Ziel
Photorhabdus luminescens lebt symbiotisch mit Nematoden. Die winzigen Würmer dringen durch natürliche Öffnungen in Insektenlarven ein, wo sie die Bakterien gewissermaßen wieder „herauswürgen“. Bakterielle Toxine, die vom Licht-emittierenden Keim produziert werden, töten die Insektenlarven und schaffen dadurch ein großes Nahrungsreservoir für die Vermehrung von Nematoden und Bakterien.
Zwei Untereinheiten des Toxinkomplexes sind biologisch aktiv
Photorhabdus luminescens produziert verschiedene Gifte, die große Toxin-Komplexe (Tc-Proteine) bilden. Der biologisch aktive Komplex besteht dabei aus den drei Komponenten TcA, TcB und TcC. Bis heute ist weder eine enzymatische Aktivität noch ein Wirkungsmechanismus für diese Toxine beschrieben worden.