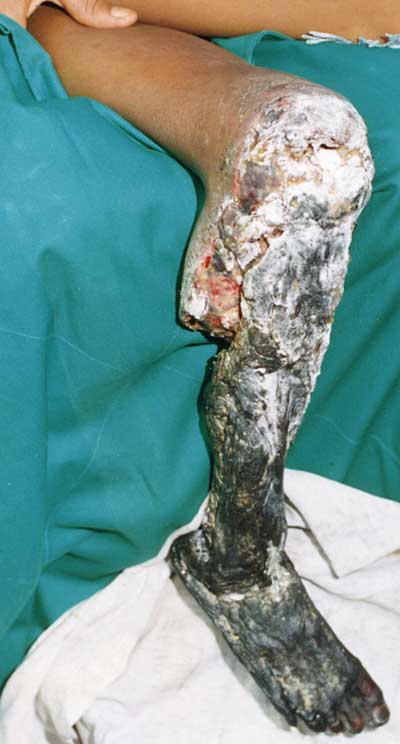
Vipernbisse können unbehandelt zum Absterben von Gliedmaßen des Opfers und sogar zu dessen Tod führen. Innsbrucker Chemiker haben jetzt erstmals nachgewiesen, dass diese gefürchtete Wirkung des Schlangengiftes von der Beweglichkeit eines Enzyms im Giftcocktail abhängt. Sie stellen die Ergebnisse ihrer neuen Studie im „Journal of the American Chemical Society“ ausführlich vor.
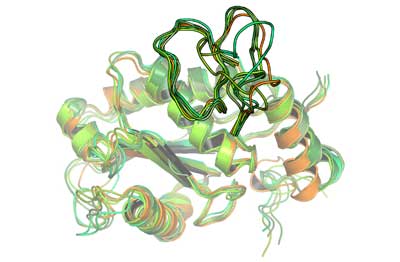
Einige Viperngifte führen aufgrund ihrer Blutgefäß-zersetzenden Wirkung zum Absterben des umgebenden Gewebes, wobei sich diese Wirkung oft auf das gesamte vom Biss betroffene Körperteil ausbreitet. Obwohl die Aminosäuresequenz und sogar die Struktur der Giftproteine in Viperngiften bekannt sind, gab es bis heute jedoch keine Erklärung, warum manche dieser Enzyme zu ausgedehnten Gewebeschäden führen, während andere nur einen örtlich beschränkten Schaden bewirken. Für Schlangengiftexperten war dies umso erstaunlicher, da die Sequenz und Struktur der aktiven und inaktiven Giftproteine nahezu identisch sind.
Unterschiede in der Beweglichkeit entscheidend
Das Forscherteam um Professor Klaus R. Liedl vom Institut für Allgemeine, Anorganische und Theoretische Chemie der Universität Innsbruck konnte nun erstmals eine Erklärung für dieses Phänomen finden und nachweisen.
„Hannes Wallnöfer aus unserer Arbeitsgruppe konnte mittels Computersimulation erstmals zeigen, dass der Unterschied zwischen den einzelnen Giftproteinen nicht durch ein statisches Bild der Enzyme erklärt werden kann“, erläutert Liedl. Demnach ist die unterschiedliche Wirkung nicht auf Unterschiede in der Struktur sondern auf Unterschiede in der Beweglichkeit zurückzuführen.