Ein amerikanisches Forscherteam hat erstmals die komplette Proteinstruktur der Hülle des Aids-Virus entschlüsselt. Die Hüllproteine sind entscheidend für das Eindringen des Virus in die Wirtszelle und die Übertragung der Virengene. Bisher war erst die Struktur einzelner Bereiche der Virenhülle geklärt worden, die letzten fehlenden Puzzleteile hat jetzt die in „Nature“ veröffentlichte Studie hinzugefügt. Sie eröffnet damit auch neue Möglichkeiten, das Entstehen vermehrungsfähiger Viren zu blockieren.
Wenn der Aids-Erreger eine Wirtszelle entert, nutzt er deren Zellmaschinerie, um aus seinem genetischen Material neue Viren herstellen zu lassen. Die neu entstehenden Viren tragen eine Art „Jugendkleid“: Ihre Außenhülle, das Capsid, ist noch unreif und die darauf sitzenden Proteine liegen noch nicht in ihrer endgültigen Form vor. Erst nachdem die jungen Viren die Wirtszelle verlassen haben, wird ihr Capsid einer dramatischen Neuordnung unterzogen und befähigt sie von da an, nun selbst Zellen zu befallen.
Röntgenkristallografie des Gesamt-Capsids unmöglich
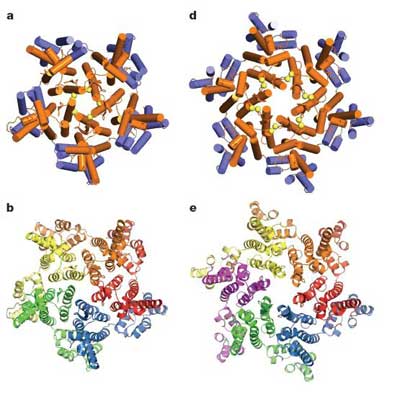
Diese Phase der Umordnung könnte man sich für die Aids-Bekämpfung zu Nutze machen, indem man die Ausreifung des Capsids blockiert und damit die neuen HI-Viren vermehrungsunfähig macht. Doch dies scheiterte bisher daran, dass die Bildung und genaue Struktur des HIV-Capsids nicht bekannt war. Die bei anderen Viren eingesetzte Methode der Röntgenkristallografie funktioniert beim HI-Virus nicht, da dessen Capsid flexibel ist und leicht unterschiedliche Formen annehmen kann.
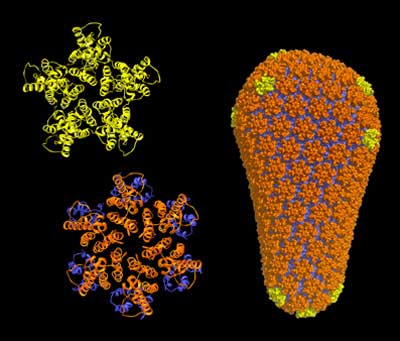
„Es ist schlicht unmöglich, Kristalle aus dem gesamten Capsid zu züchten“, erklärt Mark Yeager, Professor am Scripps Research Institute und der Universität von Virginia. Der Grund dafür ist die Struktur des Capsid-Proteins: Das CA-Protein besteht aus zwei Untereinheiten, die durch eine bewegliche „Brücke“ miteinander verknüpft sind. Jeweils sechs dieser Proteine sind zu „Hexameren“ zusammengelagert. 250 von diesen wiederum bilden den Hauptkörper des zylindrischen Capsids, das an den runden Enden von mehreren fünfzähligen CA-Einheiten geschlossen wird.