Ein Forschertraum seit mehr als einem Jahrzehnt ist nun wahr geworden: Erstmals ist es einem internationalen Forscherteam gelungen, biologische Strukturen ohne vorherige langwierige Kristallisation hochauflösend abzubilden. Dies gelang mit Hilfe eines starken Röntgenlasers, der Aufnahmen durch ultrakurze und extrem intensive Röntgenblitze machte. Die Experimente, in gleich zwei Beiträgen in der aktuellen „Nature“ veröffentlicht, sind ein erster und entscheidender Schritt, um molekulare Strukturen von Proteinen oder Viren ohne aufwändige Kristallisation bestimmen zu können.
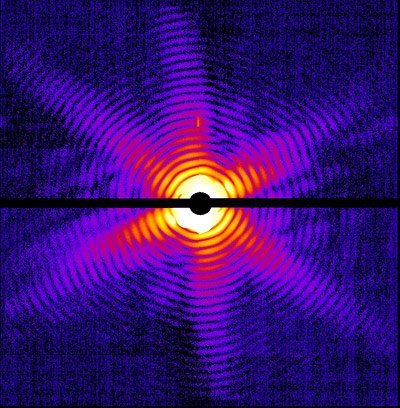
Die 3D-Strukturen von Proteinen und Viren werden üblicherweise mit Hilfe der so genannten Röntgenkristallographie aufgezeichnet. Dabei trifft ein Röntgenstrahl auf den Kristall, und es entsteht eine Anordnung von Punkten, das so genannte Röntgenbeugungsmuster. Während der Kristall im Röntgenstrahl gedreht wird, gibt die gemessene Intensität dieser Punkte ein dreidimensionales Abbild der Probe. Allerdings werden die Testobjekte bei der Untersuchung von der intensiven ionisierenden Strahlung zerstört. Deshalb sind große und aufwändig herzustellende Kristalle notwendig, um deutliche Beugungsmuster zu erzielen, bevor die Zerstörung einsetzt. Dieses Verfahren scheitert daher oft daran, dass eine einwandfreie Kristallisation von vielen Biomolekülen nicht möglich ist.
Ultrakurze Röntgenblitze ermöglichen Schnappschüsse ohne große Kristalle
Neu entwickelten Freie-Elektronen-Laser produzieren jedoch so ultrakurze, extremhelle Lichtblitze, dass sich mit ihnen Bilder aufnehmen lassen, bevor der Zerstörungseffekt eintritt. Der Freie-Elektronen-Laser LCLS in Stanford produziert Röntgenblitze, die so intensiv sind, dass jede Probe in dem Strahl zu einem Plasma verdampft. Doch der Blitz erzeugt kurz vorher, in nur 100 Femtosekunden, die Aufnahme. Die Blitze sind zudem so intensiv, dass die Beugungsmuster winziger Nanokristalle oder sogar einzelner Viruspartikel intensiv genug für die Auswertung sind – ohne dass erst mühsam große Kristalle gezüchtet werden müssen.
Experiment belegt Funktionieren des Prinzips
Das dieses theoretisch schon seit längerem bekannte Prinzip auch wirklich bei den kleinsten Biomolekülen funktioniert, hat jetzt ein internationales Forscherteam unter Leitung von Professor Henry Chapman vom Center for Free-Electron Laser Science (CFEL) bei DESY in Hamburg am Freie-Elektronen-Laser LCLS an Proteinen und Viren nachgewiesen. „Diese Experimente sind ein Durchbruch auf unserem Weg zur Röntgenbeugung von Einzelobjekten“, so Professor Helmut Dosch, Vorsitzender des DESY- Direktoriums. „Wir schauen in die Welt von morgen, in der wir Aufnahmen von nicht-kristallinem Material mit Röntgenlasern in den Griff bekommen werden.“