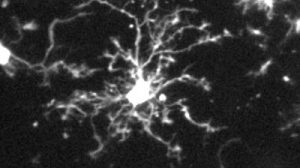
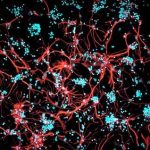
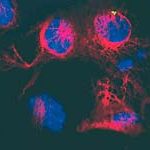
Ein Schlüsselfaktor bei der Entstehung von Alzheimer ist das Protein Tau. Während dieses normalerweise vor allem im langen Zellfortsatz zur Reizweiterleitung vorkommt, lässt es sich bei Alzheimer-Patienten auch im Zellkörper und seinen feinen Verästelungen der Dendriten nachweisen. Dort verklumpt es und führt schließlich zum Tod der Zelle. Max-Planck-Forscher haben nun einen neuen Mechanismus identifiziert, der für die korrekte Verteilung des Proteins in der Nervenzelle sorgt.
Die Entdeckung sei ein wichtiger Schritt, um die molekularen Ursachen der Demenzerkrankung aufzuklären, berichten die Wissenschaftler in der Fachzeitschrift „EMBO Journal“.
Tau stabilisiert das Zellskelett
Bei Morbus Alzheimer steht ein Molekül im Zentrum des Geschehens: Das Protein Tau stabilisiert in einer gesunden Nervenzelle das Zellskelett im Axon. Typisch für die Alzheimer-Krankheit ist es, dass das Protein mit zusätzlichen Phosphatgruppen bestückt ist. Die überzähligen Anhänge des so genannten phosphorylierten Proteins behindern seine Bindung an röhrenförmige Fasern des Zellskeletts, die Mikrotubuli. Daraufhin löst sich Tau von den Mikrotubuli, verklumpt und führt zur Degeneration der Nervenzelle.
Entscheidend dafür, dass Tau seine Aufgabe erfüllen kann, ist die richtige Verteilung in der Nervenzelle. Während das Protein in gesunden, ausdifferenzierten Neuronen hauptsächlich im Axon vorkommt, nicht aber im Zellkörper oder den Dendriten, findet es sich bei Alzheimer-Patienten in der gesamten Zelle, und zwar schon lange, bevor Krankheitssymptome auftreten. Dass diese Fehlverteilung eine wichtige Rolle bei der Entwicklung des Leidens spielt, war bereits seit Längerem bekannt. Wie Nervenzellen für die korrekte Sortierung sorgen, lag hingegen weitgehend im Dunkeln.
„Molekulares Ventil“ entdeckt
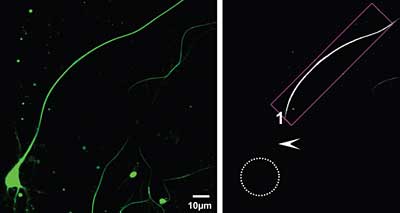
Wissenschaftler der Max-Planck-Arbeitsgruppe für strukturelle Molekularbiologie in Hamburg haben nun ein „molekulares Ventil“ dafür entdeckt, dass Tau zwar aus dem Zellkörper ins Axon diffundieren kann, nicht aber wieder aus dem Axon hinaus. Diese Barriere liegt im Anfangsbereich des langen Zellfortsatzes direkt hinter dem so genannten Axonhügel.
„Den genauen Mechanismus kennen wir noch nicht, aber aufgrund von Modellrechnungen nehmen wir an, dass es sich dabei um ein dynamisches System handelt, das Tau immer wieder in Richtung Axon transportiert“, sagt Eckhard Mandelkow, der die molekulare Barriere gemeinsam mit seinem Team entdeckt hat. „Erreicht werden könnte dies durch speziell modifizierte Mikrotubuli, bestimmte Motorproteine und ein gesundes, normal phosphoryliertes Tau-Protein.“
Fluoreszierender Farbstoff im Einsatz
Denn wie die Forscher herausgefunden haben, versagt die Barriere, wenn Tau eine veränderte Struktur aufweist: Um die Bewegung von phosphorylierten und nicht-phosphorylierten Tau-Varianten in der Zelle zu verfolgen, haben die Forscher die verschiedenen Moleküle mit einem fluoreszierenden Farbstoff markiert. Dessen Besonderheit ist es, unter Einfluss von kurzwelligem Licht seine Farbe zu wechseln.
Indem die Wissenschaftler einen kleinen Bereich der Zelle mit Laserlicht bestrahlen, können sie in Echtzeit und in Farbe beobachten, in welche Richtung sich das rot leuchtende Tau vom angestrahlten Areal aus fortbewegt. Mit dem Mikrotubuli-abbauendem Wirkstoff Nocodazol konnten die Forscher die molekulare Blockade außer Kraft setzen: Tau gelangte aus dem Axon in den Zellkörper.
„Wenn wir herausfinden, warum die Blockade bei Alzheimer zusammenbricht, können wir hier ansetzen, um neue Therapien zu entwickeln“, sagt Mandelkow. (EMBO Journal, 2011; doi:10.1038/emboj.2011.376)
(MPG, 02.11.2011 – DLO)