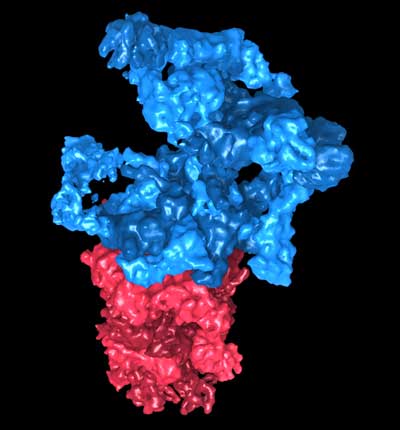
Werden fehlerhafte Proteine nicht vom Körper abgebaut, können sie Krankheiten verursachen. Wissenschaftlern ist es jetzt gelungen, die Struktur der „Müllabfuhr“ der Zelle (26S-Proteasom) aufzuklären. Die Ergebnisse der neuen Studie sind ein wichtiger Schritt für die weitere Erforschung des 26S-Proteasoms, schreiben die Forscher in der Fachzeitschrift „Proceedings of the National Academy of Sciences“ (PNAS).
In einer Zelle dürfen zu einem bestimmten Zeitpunkt ihrer Entwicklung nur die Proteine vorhanden sein, die sie gerade benötigt. Andernfalls können unerwünschte Reaktionen auftreten, die beispielsweise zu Krebs führen können. Außerdem müssen die Proteine die korrekte Form aufweisen, um ihre Aufgaben erfüllen zu können.
Sind sie falsch gefaltet, können sie verklumpen und neurodegenerative Krankheiten wie Alzheimer oder Parkinson die Folge sein. Um das zu verhindern, verfügt der Körper über verschiedene Mechanismen, die den Proteinhaushalt regulieren und wenn nötig Proteine abbauen.
Zelluläre Müllabfuhr
Eine zentrale Rolle beim Proteinabbau spielt die zellulären Proteinabbau-Maschinerie, das 26S-Proteasom. Fehlgefaltete und potentiell gefährliche Proteine werden zunächst mit dem zellulären Etikett Ubiquitin verknüpft. Das 26S-Proteasom erkennt die markierten Proteine und zerlegt sie in ihre Bestandteile, die dann wiederverwertet werden.