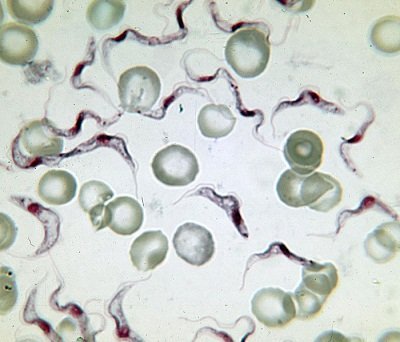
Die Erreger der tödlichen Afrikanischen Schlafkrankheit, die einzelligen, verhalten sich erstaunlich altruistisch, um die Wirtsinfektion zu starten: Eine Vorhut opfert sich als Kanonenfutter den Fresszellen des Immunsystems, um diese zu lähmen und den folgenden Trypanosomen den Weg frei zu machen.
Im tropischen Afrika werden Trypanosomen von blutsaugenden Tsetsefliegen übertragen und verursachen die Schlafkrankheit. Für diese vernachlässigte Tropenerkrankung gibt es keine Impfung und nur wenige Medikamente mit schweren Nebenwirkungen. Der Körperabwehr sind die einzelligen Erreger immer eine Nasenlänge voraus, weil sie ihre Antigene – eine Art molekulare Erkennungszeichen – extrem flexibel variieren können. Für ihre perfekte Antigenvariation wurden Trypanosomen bei Molekularbiologen erst berühmt. Wie aber überwinden die Trypanosomen die erste Hürde der angeborenen Immunabwehr des Säugerwirts?
Wie Forscher um Michael Boshart von der Ludwigs-Maximilians-Universität München und seinen belgischen Kollegen Etienne Pays nun zeigt, verhalten sich Trypanosomen erstaunlicherweise altruistisch – eine Vorhut opfert sich als Kanonenfutter den Fresszellen des Immunsystems um diese zu lähmen und den folgenden Trypanosomen den Weg frei zu machen.

Rätselhafte Rezeptoren untersucht
Ausgangspunkt des Projekts war die Frage, welche Rolle die sogenannten Adenylatzyklasen spielen. Bei diesen handelt es sich um molekulare Rezeptoren an der Oberfläche der Trypanosomen. Sie werden durch die ungewöhnlich große Anzahl von über 80 Genen kodiert und produzieren den intrazellulären Botenstoff cAMP. „Wir wollten die Funktion sowie die überraschende Diversität dieser Genfamilie untersuchen und an diesem Beispiel ganz grundsätzlich die Evolution von molekularen Signalsystemen studieren“, sagt Boshart.