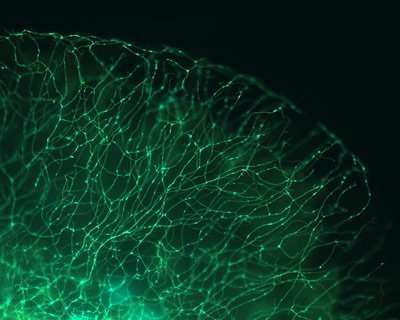
Durch geschickte Manipulation haben Forscher aus einem Zebrafisch ein besonderes Hilfsmittel der Forschung gemacht: Sie markierten Nervenzellen des Fischs mit Leuchtproteinen und konnten so später genau verfolgen, wie gut die Kraftwerke der Zelle, die Mitochondrien, in den Nervenfasern und -zellen verteilt sind. Da die Mitochondrien an vielen Abbauerkrankungen des Gehirns und der Nerven beteiligt sind, trage der MitoFish dazu bei, neue Ansatzpunkte für wirksame Medikamente zu finden, berichten die Forscher im “ Journal of Neuroscience „.
Neurodegenerative Erkrankungen wie die Alzheimer, Parkinson, Amyotrophe Lateralsklerose und Multiple Sklerose zeigen ganz verschiedene Symptome, und unterscheiden sich in ihrem Verlauf. Auf der Ebene einzelner Neuronen jedoch haben sie teilweise gemeinsame Mechanismen. Beispielsweise ist eine Beeinträchtigung des Transportes von Mitochondrien in Nervenfasern ein weit verbreitetes Phänomen, das den Abbau von Nervenzellen beschleunigen könnte. Mitochondrien sind essentielle Organellen, die Zellen die notwendige Energie liefern, aber auch andere wichtige Aspekte des zellulären Verhaltens regulieren. Gerade in Nervenzellen, die besonders viel Energie verbrauchen, müssen auch lange Fortsätze, die Axone, mit Energie und daher mit Mitochondrien versorgt werden.
Erste Erkenntnisse zum Transport von Mitochondrien bei neurodegenerativer Erkrankungen stammen vor allem aus Mausmodellen. Die Beobachtung von mitochondrialem Transport in Zebrafischen und die Entwicklung eines weiteren Tiermodells — des MitoFish — zur Untersuchung von Mitochondrien, eröffnen jetzt neue Möglichkeiten. Denn die Fische sind in ihrer frühen Lebensphasen durchsichtig, so dass markierte Moleküle und ihr Transport direkt von außen beobachtet werden können.
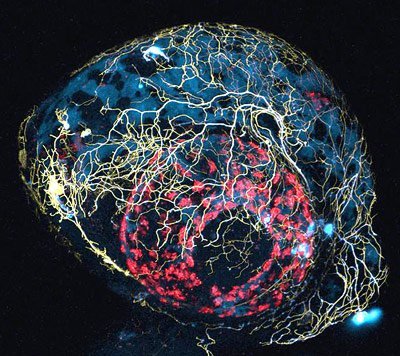
Blick von außen in die Nervenbahnen
Forscher der der Technischen Universität München entwickelten gemeinsam mit weiteren Kollegen einen transgene Zebrafisch, den MitoFish. „Der Zebrafisch ist ein etabliertes Modell in der Genetik“, erläutert Bettina Schmid vom Deutschen Zentrum für neurodegenerative Erkrankungen (DZNE). „Das bedeutet, dass wir fremde Gene oder spezifische Proteine in diese Fische einbringen können und damit verschiedene Hypothesen zur Grundlagenforschung, zur Entstehung von Erkrankungen oder auch zu potenziellen Therapien testen können.“
Weil die Fische in der frühen Embryonalphase durchsichtig sind, könne man einzelne Nervenzellen mit fluoreszierenden Proteinen markieren und sie dann am intakten, lebenden Tier beobachten. Direkt sehen lässt sich dadurch beispielsweise, wie der Transport von Mitochondrien, den Kraftwerken der Zelle, bei Gehirnerkrankungen beeinträchtigt wird. „Mit diesem Modellsystem können wir versuchen, den Lebenszyklus bestimmter Zellorganellen – in diesem Fall der Mitochondrien – direkt in einer lebenden Zelle, die sich in ihrer physiologischen Umgebung entwickelt, zu studieren“, sagt Thomas Misgeld von der TU München. „Viele Aspekte der Organellenbiologie verstehen wir nicht gut genug, um sie in anderen, einfacheren Systemen nachzustellen, so dass wir einfach den Zebrafisch nutzen, der dies quasi für uns erledigt.“ (doi:10.1523/JNEUROSCI.1327-12.2012)
(Technische Universität München, 07.12.2012 – NPO)