Wie ein Spiegelei in der Pfanne: Durchsichtige, gelöste Proteine können unter Stress oder Hitze verklumpen und trübe werden. Passiert dies in der Linse des Auges, droht dauerhafte Blindheit durch grauen Star. Münchner Wissenschaftler veröffentlichten in den Proceedings of the National Academy of Science nun, wie sie diese Krankheit in Zukunft zu verhindern hoffen.
Die Augenlinse des Menschen besteht aus einer hochkonzentrierten Proteinlösung, die ihr ihre hohe Brechkraft verleiht. Trotz dieses hohen Eiweißgehalts muss die Linse jedoch klar und lichtdurchlässig bleiben. Aus diesem Grund liegen hier einzigartige Bedingungen vor: Die Linsenzellen verzichten komplett auf die komplexe, in allen anderen Körperzellen vorhandene Maschinerie zum Auf- und Abbau von Proteinen. Stattdessen werden die Linsenproteine nur ein einziges Mal in der Embryonalentwicklung angelegt. Sie sind also so alt wie der Organismus selbst. Damit sie ein Menschenleben lang funktionieren, müssen die Eiweiße permanent in gelöstem Zustand gehalten werden. Verklumpen sie, führt das zu einer Trübung der Linse – grauer Star ist die Folge.
Alternative zur Operation
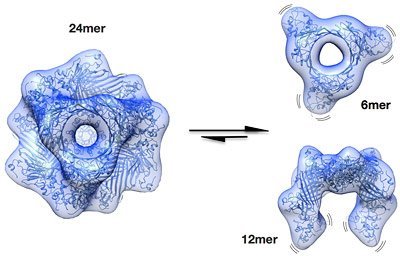
Bislang kann diese Erkrankung nur operativ, durch das Einsetzen einer künstlichen Linse, behandelt werden. Wäre jedoch der genaue Wirkmechanismus bekannt, der die Linsenproteine in ihrem gelösten Zustand erhält, könnte dies den Weg zu neuen Therapiemöglichkeiten eröffnen. Wie also schafft es die Zelle die Proteine so lange löslich zu halten? Verantwortlich hierfür sind zwei Schutzproteine, das sogenannte αA-Crystallin und sein Verwandter, das αB-Crystallin. Sie sind die bekanntesten Vertreter der Klasse der kleinen Hitzeschockproteine, die in vielen Körperzellen eine wesentliche Rolle spielen, denn sie bewahren andere Proteine davor, bei starker Hitze oder zellulärem Stress zu einem unbrauchbaren Knäuel zu verklumpen.
Wie diese Schutzproteine jedoch genau aussehen und wirken, war trotz intensiver Forschung lange unbekannt. „Die große Herausforderung bei der Analyse der beiden Crystalline liegt in ihrer großen strukturellen Vielfalt“, erklärt Johannes Buchner, Professor für Biotechnologie der Technischen Universität München. „Es liegt ein Gemisch ganz verschiedener Formen vor, die sich aus unterschiedlich vielen Untereinheiten zusammensetzen. Dies macht es sehr schwer, die einzelnen Strukturen voneinander zu unterscheiden.“