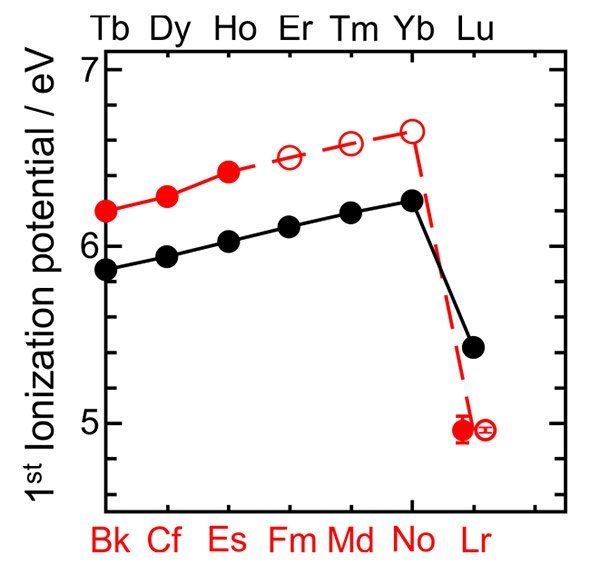
Umstrittenes Schwergewicht: Das Element Lawrencium steht möglicherweise an der falschen Stelle des Periodensystems. Denn wie ein Experiment nun erstmals zeigt, ist seine Ionisierungs-Energie verblüffend niedrig – niedriger als die aller anderen Actinoide und Lanthanoide. Dies heizt die Diskussion über die Position dieses kurzlebigen Elements wieder an – und über die Ordnung des Periodensystems insgesamt.
Die Position im Periodensystem spiegelt die Grundeigenschaften eines Elements wider: In welcher Gruppe sie stehen, verrät beispielsweise, wie viele Elektronen ihrer äußeren Hülle sie in einer chemischen Reaktion abgeben oder wie viele Elektronen sie vom Reaktionspartner aufnehmen. Auch die Leichtigkeit, mit der dies geschieht, lässt sich an der Position ablesen. Die großen Blöcke des Periodensystems zeigen, welches Elektronenorbital dabei die entscheidende Rolle spielt.
Eine Frage der Elektronen
Um herauszufinden, wohin ein Element im Periodensystem gehört, muss man daher die Anordnung seiner Elektronen kennen, aber auch seine Ionisierungs-Energie – die Energie, die benötigt wird, um ihm eines seiner Außenelektronen wegzunehmen. Bei alltäglichen, stabilen Elementen wie Sauerstoff oder Eisen ist das nicht weiter schwer, bei den superschweren, teilweise extrem kurzlebigen Elementen, die sich am unteren Rand des Systems tummeln, aber schon.
Einer dieser Wackelkandidaten ist Lawrencium (Lr), denn seine Ionisierungs-Energie war bisher nicht bekannt. Das Element mit der Ordnungszahl 103 steht vorläufig ganz am Ende der Actinoide, einer Gruppe, die zusammen mit den Lanthanoiden einen eigenen Block im Periodensystem bildet. In diesem f-Block bleibt die äußere Schale unverändert, die Atome erhalten aber von Element zu Element jeweils ein Elektron im drittäußersten f-Orbital hinzu.