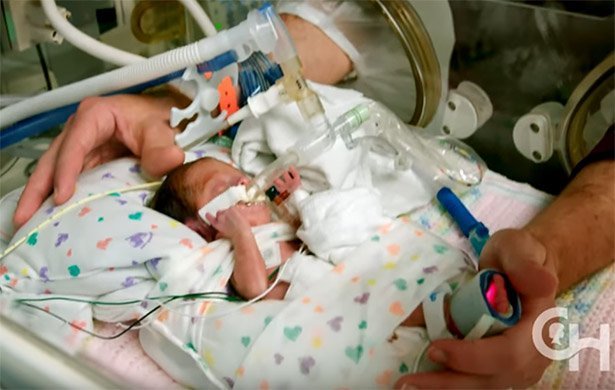
Fruchtwasser und Nabelschnur
Das „Biobag“ getaufte System der Forscher besteht aus einem durchsichtigen Kunststoffsack, der Fruchtwasser und den Fötus enthält. Über Verbindungen nach außen wird das Fruchtwasser ständig erneuert. Wie im Mutterleib kann der Fötus das Fruchtwasser schlucken und „einatmen“. „Die Lungen des Ungeborenen sind dafür ausgelegt, in Flüssigkeit zu funktionieren und genau diese Umgebung simulieren wir hier“, sagt Flakes Kollege Marcus Davey. „Das Fruchtwasser erlaubt es den Lungen und anderen Organen, sich zu entwickeln und liefert ihnen dafür die Nährstoffe und Wachstumsfaktoren.“
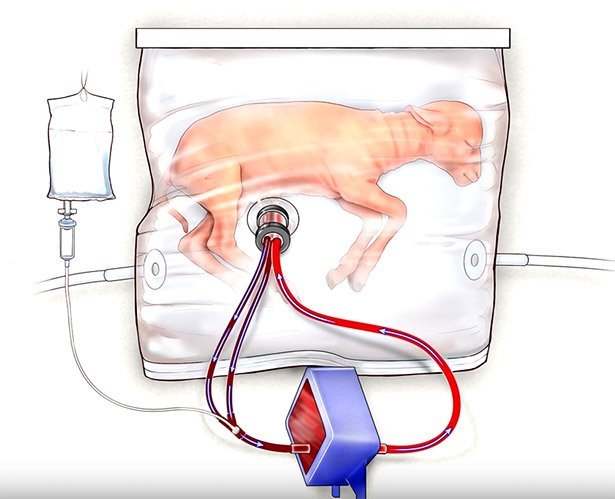
Bei Tests mit frühgeborenen Lämmern funktionierte der "Biobag" bereits recht gut © Children's Hospital of Philadelphia
Frisches Blut und Sauerstoff erhält der Fötus über die Nabelschnur: Ein externes System entfernt Kohlendioxid aus dem Blut und setzt Sauerstoff zu – ähnlich wie es die Lunge der Mutter normalerweise tun würde. Angetrieben wird diese Blutwäsche jedoch nicht von einer externen Pumpe, wie die Forscher betonen, sondern ausschließlich vom Herz des Fötus selbst. Der Grund dafür: Selbst ein geringer künstlicher Druck könnte das Herz des Ungeborenen überfordern und zu irreversiblen Schäden führen.
Tests mit Lämmern erfolgreich
Ob diese künstliche Gebärmutter funktioniert, testeten die Forscher an acht Lammföten, deren Entwicklungszustand einem menschlichen Fötus in der 23. bis 24. Schwangerschaftswoche entspricht. Und tatsächlich: Die Lämmer-Frühchen überlebten in diesem Lebenserhaltungssystem bis zu vier Wochen lang und entwickelten sich weitgehend normal. Nähere Analysen ergaben, dass auch die Lungenreifung normal fortschritt und es keine Auffälligkeiten bei der Gehirnentwicklung gab.
„Die Tiere öffneten ihre Augen, wurden aktiver, hatten offenbar eine normale Atmung und Schluckbewegungen und bildeten Wolle“, berichten die Forscher. „Allgemein schien es den Tieren gutzugehen und sie zeigten keine Stresssymptome.“ Das Größenwachstum der Lämmer entsprach in etwa dem von Kontrolltieren, die in ihren Mutterschafen heranwuchsen. Einige konnten danach ohne künstliche Beatmung selbstständig atmen, andere benötigten ähnlich wie menschliche Frühgeborene eine Beatmung.
Wie die „künstliche Gebärmutter“ extremen Frühgeborenen helfen könnte© Children’s Hospital of Philadelphia
Auf den Menschen übertragbar?
Nach Ansicht der Wissenschaftler könnte ihr „Biobag“ in Zukunft auch für menschliche Frühgeborene eingesetzt werden. Dafür müsste das System allerdings an die geringere Größe von menschlichen Föten angepasst und weiterentwickelt werden. „Unser System könnte die schwerwiegenden Schäden verhindern, die extrem frühgeborene Kinder bisher erleiden“, sagt Flake.
Er hält es für durchaus wahrscheinlich, dass schon in rund zehn Jahren solche fruchtwassergefüllten Systeme die bisherigen Brutkästen und Beatmungsgeräte in solchen Fällen ersetzen werden. Etwas weniger optimistisch sieht dies Thomas Kohl, Leiter des Deutschen Zentrums für Fetalchirurgie in Gießen: „Prinzipiell lassen sich die gewonnenen Erkenntnisse auf den Menschen übertragen“, schreibt er in einem Kommentar. Allerdings seien noch Jahre der Weiterentwicklung dafür nötig.
Neue ethische Fragen
Die neue Technologie könnte aber auch neue ethische Fragen aufwerfen. Denn mit ihr könnten künftig immer jüngere Frühgeborene mit allen Mitteln am Leben erhalten werden, so die Befürchtung einiger Wissenschaftler. „Wenngleich der Biobag das Dilemma für die aktuelle Grauzone zu entschärfen verspricht, kann es auch sein, dass die neue Technologie diese Grauzone nur nach vorne verschieben würde“, kommentiert Peter Dabrock, Vorsitzender des Deutschen Ethikrats.
Flake und seine Kollegen betonen dazu: „Unser Ziel ist es nicht, die bisherige Grenze der Lebensfähigkeit weiter zu verschieben. Stattdessen wollen wir die Chancen für die Frühgeborenen verbessern, die ohnehin schon in den neonatologischen Intensivstationen beatmet und versorgt werden.“ Sie sehen in ihrem System eher die Brücke, die extremen Frühchen über die kritische Phase bis zur 28. Woche hilft und das Risiko für Komplikationen und bleibende Schäden senkt. (Nature Communications, 2017; doi: 10.1038/ncomms15112)
(Children’s Hospital of Philadelphia, 26.04.2017 – NPO)
26. April 2017