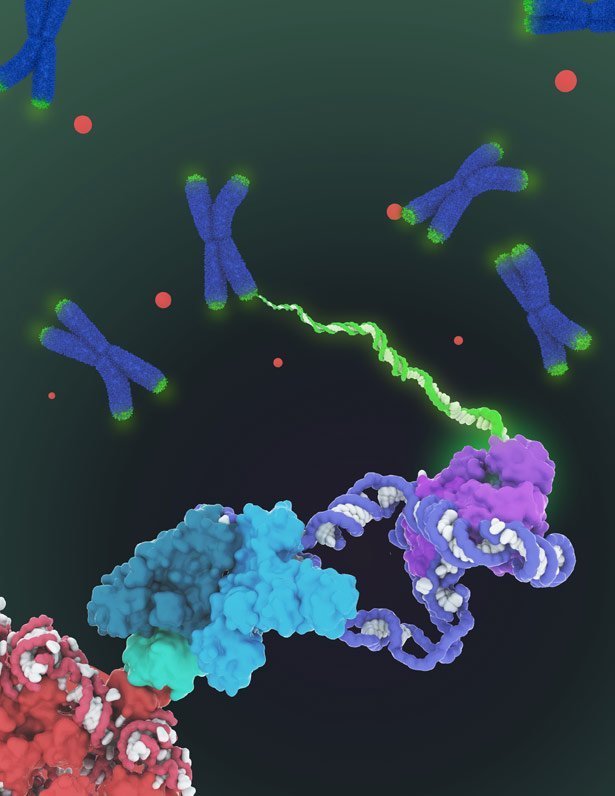
Zoom aufs Enzym: Forschern ist ein beispiellos detaillierter Blick auf die menschliche Telomerase gelungen. Sie beobachteten das Enzym, das unsere Chromosomen mit schützenden Kappen versorgt, mithilfe der Kryo-Elektronenmikroskopie in dreifach besserer Auflösung als bisher möglich war. Ihre neuen Erkenntnisse über die Struktur und Funktionsweise des Enzyms könnten auf lange Sicht bei der Bekämpfung von Alterungsprozessen und Krebs helfen.
Die Chromosomen in den Zellen aller eukaryotischen Lebewesen sind mit schützenden Kappen ausgestattet – den sogenannten Telomeren. Sie bestehen aus kurzen, spezialisierten DNA-Sequenzen, die das darunterliegende Erbgut von schädlichen Einflüssen abschirmen. Ihre Funktion wird oftmals mit der der Plastikstücke an den Enden von Schuhbändern verglichen. Doch ihr schützender Effekt hält nicht ewig: Jedes Mal, wenn sich eine Zelle teilt, werden die Telomere ein kleines Stück kürzer.
Verantwortlich für den Aufbau der Telomere ist ein Enzym namens Telomerase. Dieses ist in den meisten erwachsenen Zellen nicht mehr aktiv. Aus diesem Grund wachsen die Telomere im Laufe unseres Lebens nicht nach und alte Zellen nehmen irgendwann Schaden und teilen sich nicht mehr. Mit einer Ausnahme: In Krebszellen arbeitet die Telomerase kontinuierlich. Dadurch verhilft sie ihnen dazu, sich unendlich oft zu teilen und im Körper zu wuchern.
Unbekannte Struktur
Wissenschaftlern gilt das Enzym daher schon länger als Schlüsselstelle für die Entwicklung von Therapien gegen Krebs und Alterungsprozesse. Doch praktisch umgesetzt wurden Medikamente, die die Telomerase aktivieren oder blockieren bisher noch nicht. Der Grund: Forscher wussten bis jetzt einfach zu wenig über die Struktur und Funktionsweise des Enzyms, das sich aus RNA-Molekülen und Proteinen zusammensetzt.