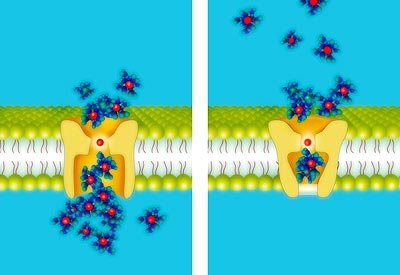
Ionen schlüpfen durch die Zemllmembran
Damit Natrium- und Kaliumionen durch die Zellmembran „schlüpfen“ können, stellt die Natur spezielle Proteine, sogenannte Ionenkanäle, zur Verfügung. Diese Kanäle sind mikroskopisch kleine Poren in der Membran, die je nach molekularer Bauweise nur für bestimmte Ionen durchlässig sind, und zum Beispiel Natrium- von Kaliumionen unterscheiden können. Die engste Stelle – hier hat der untersuchte Ionenkanal nur einen Durchmesser von etwa drei Ångström (ein Å = 10-7 Millimeter) – fungiert dabei als Selektivitätsfilter.
Der an den Selektivitätsfilter anschließende Teil der Pore – von den Wissenschaftlern als „Gate“ bezeichnet – ist mit einem Durchmesser von zwölf Ångström schon deutlich weiter. Als Reaktion auf eine Änderung der Membranspannung können Ionenkanäle den Durchmesser ihres „Gates“ vergrößern oder verkleinern. Diese Konformationsänderung reicht aber nicht notwendigerweise aus, um den Ionenstrom zu stoppen.
Wasserabweisendes Gate
Ein wichtiges Detail dabei ist, dass das „Gate“ typischerweise leicht hydrophob, also wasserabweisend ist. Wenn das „Gate“ weit genug ist, spielt die Wechselwirkung zwischen Wassermolekülen und dem Protein eine untergeordnete Rolle, weil im Mittel jedes Wassermolekül von mehreren Wassermolekülen umgeben ist.
Wird das Gate aber enger, dann gewinnt die Wechselwirkung zwischen Wassermolekülen und dem Protein an Bedeutung. Wird schließlich ein bestimmter Wert für den Durchmesser des „Gates“ unterschritten, dann ist es – aufgrund der abstoßenden Wirkung zwischen Wassermolekülen und Protein – sehr unwahrscheinlich, noch Wasser im „Gate“ zu finden. Es bildet sich hier stattdessen ein kleines Gasbläschen, das große Wirkung zeigt: Ionen, die sich am liebsten in Wasser befinden, treffen auf eine schier undurchdringbare Barriere. Damit unterbricht das Gasbläschen den Ionenstrom durch den Kanal und schließt das „Gate“.
„Tatsächlich können eine Vielzahl von experimentellen Beobachtungen zum Öffnen und Schließen von Ionenkanälen mit diesem Modell des Bubble Gating verstanden werden“, erklärt Roland Roth vom Max-Planck-Institut für Metallforschung in Stuttgart, der zusammen mit Kollegen von der Rush Medical School in Chicago sowie der Miller School of Medicine an der Universität in Miami die neue Studie durchgeführt hat. In der Physik ist dieser Effekt von stark eingeschränkten Flüssigkeiten seit langem bekannt – nun kann er helfen, ein biologisches Phänomen zu verstehen.
Bubble Gating-Modell
Interessanterweise bietet das Bubble Gating-Modell auch eine Möglichkeit, die betäubende Wirkung eines Edelgases wie Xenon zu erklären. Wird Xenon in der richtigen Konzentration in die Atemluft gemischt, dann stellt es ein praktisch perfektes Narkotikum dar. „Da Xenon chemisch sehr träge ist, scheiden Mechanismen, die auf chemisch spezifische Bindungen aufbauen, sehr wahrscheinlich als Erklärung aus“, sagt der junge Biophysiker. „Aber Rechnungen im Bubble Gating-Modell haben gezeigt, dass Xenon schon bei geringen Konzentrationen die Wahrscheinlichkeit der Bläschenbildung erhöht, auch wenn das ‚Gate‘ noch relative weit ist.“
Im Rahmen des vorgestellten Modells können eine Reihe bekannter Phänomene zusammengefasst und theoretisch untersucht werden. Damit ermöglicht das Modell nicht nur, die faszinierenden Prozesse an Nervenzellen neu zu beleuchten, die ablaufen, wenn Sie ihre Tee- oder Kaffeetasse zum Mund führen, sondern stellt auch neue Möglichkeiten zur Verfügung, um Narkose- und Arzneimittelwirkungen zu untersuchen.
(idw – MPG, 12.03.2008 – DLO)
12. März 2008