Statt Funk und Kabel sind bei der Signalübertragung in lebenden Zellen eine Vielzahl von Proteinen beteiligt. Damit Signale richtig weitergeleitet und interpretiert werden, müssen die Aktivitäten dieser Proteine genau aufeinander abgestimmt sein. Dafür sorgt ein ausgeklügeltes Kontrollsystem, in dem so genannte Proteinkinasen eine Schlüsselrolle spielen. Wie ein internationales Wissenschaftlerteam nun herausgefunden hat, ist eine Kinase dabei offensichtlich Meister im Improvisieren.
Während alle bisher bekannten Kinasen nur mit Hilfe von Magnesium funktionieren können, hat die Pseudokinase CASK einen Trick gefunden, mit dem sie auf Magnesium ganz verzichten kann. Während der frühen Entwicklung des Nervensystems scheint sie direkt an der Ausbildung von Kontaktstellen zwischen Nervenzellen – den Synapsen – beteiligt zu sein. Pseudokinasen wie CASK galten bisher als inaktiv. Zumindest einige von ihnen dürften in der Vergangenheit zu Unrecht als nutzlos abgestempelt worden sein, so die Wissenschaftler in der Fachzeitschrift Cell.
Was tun, wenn? Nicht nur wir Menschen müssen uns ständig auf neue Situationen in unserer Umgebung einstellen und darauf reagieren. Auch lebende Zellen empfangen eine Vielzahl von Signalen, die sie richtig weiterleiten und verarbeiten müssen. Häufig werden die Zellen angeregt, zu wachsen oder sich zu teilen, einen Entwicklungsprozess zu starten oder eine Immunantwort auszulösen. Dazu müssen zahlreiche Akteure innerhalb der Zelle – die Proteine – genau aufeinander abgestimmt zusammenarbeiten. Dass sie zur richtigen Zeit und am richtigen Ort funktionieren, dafür sorgt ein komplexes Steuerungssystem.
Magnesium als Schlüsselelement?
Dabei übernehmen Proteinkinasen einen entscheidenden Part. Bis zu knapp 500 verschiedene Kinasen gibt es in einer Zelle, die jeweils bestimmte Proteine regulieren. Sie aktivieren oder hemmen Proteine, lotsen sie an bestimmte Orte in der Zelle oder blockieren ihre Wechselwirkung mit anderen Zellmolekülen. Die entsprechenden Anweisungen übermitteln Kinasen, indem sie Proteinen einen Phosphatrest anheften.
Der zugrunde liegende Reaktionsmechanismus scheint dabei bei allen Kinasen der gleiche zu sein. Mit Hilfe von Magnesium binden Kinasen ein ATP-Molekül und spalten davon einen Phosphatrest ab, den sie nachfolgend auf Proteine übertragen.
Pseudokinasen doch nicht nutzlos
Einigen wenigen Kinasen fehlt jedoch die Fähigkeit, das für die Reaktion notwendige Magnesium zu binden. Als so genannte Pseudokinasen wurden sie bisher wenig beachtet. Völlig zu unrecht, wie nun ein internationales Wissenschaftler-Team von der University of Texas (Dallas, USA), des Max-Planck-Instituts für biophysikalische Chemie in Göttingen und des Deutschen Elektronen Synchrotrons in Hamburg zeigt.
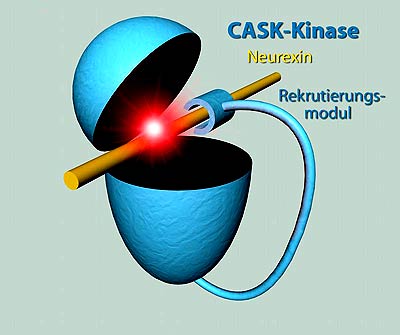
Die Wissenschaftler fanden heraus, dass in der frühen Entwicklung des Nervensystems auch eine Pseudokinase aktiv zu sein scheint: das CASK-Protein. Die Pseudokinase wechselwirkt direkt mit dem Protein Neurexin, das für die Ausbildung der Synapsen zwischen Nervenzellen wichtig ist. Entfernt man bei Mäusen die CASK-Kinase, so sterben die Tiere bereits kurz nach der Geburt.
Menschen bleiben ohne CASK in ihrer geistigen Entwicklung deutlich zurück und ihre Sehfähigkeit verkümmert. „Allerdings kann CASK kein Magnesium binden und ohne Magnesium funktionieren Kinasen nicht. Das passte für uns einfach nicht zusammen“ erläutert Neurobiologe Konark Mukherjee, einer der Projektleiter.
Daher bildeten die Forscher die Reaktion Schritt für Schritt im Reagenzglas nach. Dabei übertrug CASK ganz ohne Magnesium Phosphatreste auf Neurexin. Zugabe von Magnesium blockierte die Kinase sogar.
Doch funktioniert die Pseudokinase auch in der Zelle? Tatsächlich konnten Mukherjee und seine Forscherkollegen die gleiche Kinase-Reaktion auch in lebenden Nervenzellen von Ratten nachweisen. Dass das Protein bei seinem Reaktionsmechanismus derart „improvisiert“, hat biologisch durchaus seinen Sinn. „Zum Zeitpunkt der Synapsenbildung ist in der Nervenzelle nahezu kein Magnesium vorhanden. Magnesiumabhängige Kinasen wären
unter diesen Bedingungen schlicht nicht funktionsfähig“, sagt Mukherjee.
Ein Protein – zwei Funktionen
Die spannende Frage für die Wissenschaftler ist nun, wie eine Kinase auch ohne Magnesium funktionieren kann. Um diesen Mechanismus besser zu verstehen, arbeiteten Neurobiologen eng mit Strukturbiologen zusammen. Mit Hilfe der Röntgenkristallographie gelang es den Wissenschaftlern, die Struktur der CASK aufzuklären.
„Anders als magnesiumabhängige Kinasen ist CASK praktisch ständig aktiv. Allerdings ist sie im Vergleich zu magnesiumabhängigen Kinasen sehr viel langsamer“, fasst Markus Wahl die neuen Erkenntnisse zusammen. Die geringe Aktivität kompensiert das Protein zumindest teilweise durch einen geschickten Trick: Neben der Kinase besitzt das Protein eine weitere Untereinheit, die aktiv Neurexin-Proteine rekrutiert und damit der Pseudokinase direkt zuarbeitet.
„So kann die Kinase längere Zeit mit Neurexin-Proteinen wechselwirken und sie mit Phosphat versehen, obwohl sie langsam ist“, erklärt Wahl. Die Ergebnisse zeigen, dass der Reaktionsmechanismus von Kinasen facettenreicher ist als bisher angenommen. Auch andere Pseudokinasen, denen typische Eigenschaften von Kinasen fehlen, könnten sich zukünftig als „Spezialisten“ entpuppen, die dort aktiv sind, wo normale Kinasen ihren Dienst versagen.
(idw – Max-Planck-Institut für biophysikalische Chemie, 21.04.2008 – DLO)