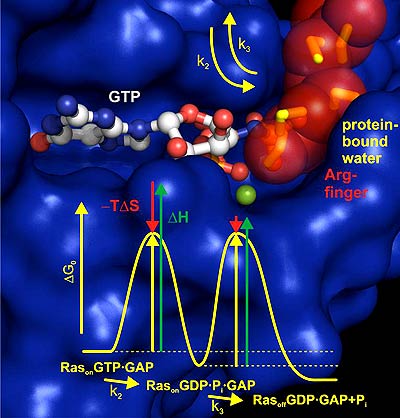
Wachstumsprozesse in lebenden Zellen werden durch die Interaktion des Proteins Ras mit dem GAP-Protein gesteuert – Störungen in diesem Prozess etwa durch Mutationen im Ras-Protein können zur Entstehung von Krebs beitragen. Forscher haben nun die katalytischen Schritte der Protein-Protein-Interaktion zwischen Ras und GAP im Detail aufgelöst.
Wie die Wissenschaftler um Professor Klaus Gerwert und Carsten Kötting von der Ruhr-Universität Bochum und Professor Alfred Wittinghofer vom Max-Planck-Institut für Molekulare Physiologie in Dortmund in den Proceedings of the National Academy of Sciences (PNAS) berichten, entdeckten sie dabei auch die entscheidende Rolle proteingebundener Wassermoleküle.
In Krebszellen findet man veränderte Ras-Proteine. Diese onkogen mutierten Ras-Proteine können nicht mehr durch das GAP-Protein abgeschaltet werden, so dass die Wachstumsprozesse außer Kontrolle geraten. Die Zellen wachsen ungebremst und schließlich entsteht ein Tumor. Ein Verständnis des Abschaltmechanismus auf der atomaren Ebene ist eine wichtige Voraussetzung dafür, gezielt nach kleinen Molekülen forschen zu können, mit denen man die Störung des Abschaltens in so genannten molekularen Therapieansätzen beheben kann.
Protein-Katalyse beobachten
Nachdem der Konstruktionsplan für die Lebensprozesse, das Genom, entschlüsselt ist, wollen Forscher jetzt herausfinden, wie die einzelnen Bauteile in der lebenden Zelle miteinander interagieren. Bei vielen Prozessen innerhalb von Zellen finden sich so genannten G-Proteine, zu denen auch Ras gehört, als wichtige regulierende Module, die Prozesse an- und abschalten können. Dabei zeigt sich, dass beim Abschalten der G-Proteine der „Arginin-Finger“ der herunter regulierenden GAP-Proteine eine katalytische Rolle spielt.