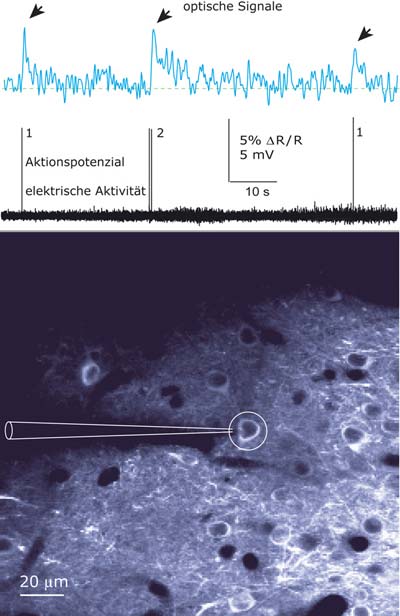
Denkprozesse sichtbar gemacht: Einem internationalen Wissenschaftlerteam ist es gelungen, einzelne Aktionspotenziale im Gehirn lebender Tiere optisch darzustellen. Über virale Genvektoren schleusten die Forscher dazu fluoreszierende Proteine als Indikatoren in die Gehirnzellen von Mäusen ein: Ein Leuchten verrät nun, welche Neuronen zu welchem Zeitpunkt miteinander kommunizieren.
Die neue Methode der Forscher um Mazahir Hasan vom Max-Planck-Institut für medizinische Forschung in Heidelberg erlaubt es, die Gehirnaktivität über viele Monate hinweg zu beobachten. Sie bietet aber auch neue Ansätze, um zum Beispiel frühzeitig Fehlfunktionen bei neurologischen Krankheiten wie Alzheimer und Parkinson zu erkennen.
Die fluoreszierenden Proteine könnten außerdem Aufschluss darüber geben, wie sich normale Alterungsprozesse auf die Kommunikation von Nervenzellen auswirken, so die Wissenschaftler in der Fachzeitschrift „Nature Methods“.
Umschlagplatz für wertvolle Informationen
Eine Nervenzelle ist ein großer Umschlagplatz für wertvolle Informationen. Nase, Augen, Ohren und andere Sinnesorgane nehmen über verschiedene Antennen, so genannte Rezeptoren, unsere Umwelt wahr. Die zahlreichen Reize werden dann an die Neuronen weitergegeben. Und an diesen Umschlagplätzen – das menschliche Gehirn zählt fast 100 Milliarden Nervenzellen – werden all diese Informationen gesammelt, verarbeitet und schließlich an bestimmte Hirnzentren weitergeleitet.
Dazu nutzt die Nervenzelle ein besonderes Transportmittel: das so genannte Aktionspotenzial – es kodiert die Informationen und ermöglicht auf diese Weise die Kommunikation zwischen den Nervenzellen.
Calcium als Startsignal
Ein solches Aktionspotenzial ist eine elektrische Erregung und entsteht immer dann, wenn unsere Nervenzellen die Information über einen entdeckten Reiz erhalten: Die Spannung über der Zellmembran des Neurons wird verändert und verschiedene Ionenkanäle öffnen und schließen nach einem ganz speziellen Muster. Kurz bevor die Nervenzelle die Information über den Reiz weiterleitet, strömen Calciumionen in die Nervenzelle – das Startsignal für den Datenfluss von einem Neuron zum nächsten.
Bislang wurde das Aktionspotenzial mit Mikroelektroden gemessen und sichtbar gemacht. Doch können auf diese Weise nur eine begrenzte Anzahl von Zellen bei ihrer Kommunikation abgehört werden. Allerdings ist es Wissenschaftlern bei dieser Methode nicht möglich die neuronale Kommunikation über einen längeren Zeitraum oder gar bei frei beweglichen Tieren festzuhalten.
Fluoreszierende Proteine
Dies könnte sich ab jetzt ändern. In Rahmen einer intensiven, internationalen Zusammenarbeit hat Hasan Nervenzellen, die ein einziges Aktionspotential abfeuern, in Mäusen optisch sichtbar gemacht. Somit kann die Kommunikation von ganzen Neuronengruppen über einen langen Zeitraum beobachtet werden. Bereits 2004 macht der Forscher auf sich aufmerksam als er als erster zeigte, dass fluoreszierende Proteine prinzipiell dazu geeignet sind, die Aktivität im Gehirn von Mäusen sichtbar zu machen.
Jetzt benutzte Hasan ein Sensor-Protein namens D3cpv, das von Amy Palmer im Labor von Roger Tsien der University of California in San Diego als Komplex zahlreicher, miteinander verknüpften Proteinuntereinheiten generiert wurde. Zwei dieser Untereinheiten reagieren auf die Bindung von Calciumionen an den Komplex: das gelb-fluoreszierende Protein (YFP) leuchtet auf und die Leuchtkraft von cyan-fluoreszierende Protein (CFP) nimmt ab – eine Koinzidenz, die sich später als entscheidend für den Erfolg der Studie herausstellten sollte.
Das entsprechende genetische Material, also die Bauanleitung für diesen Proteinkomplex, schleusten die Max-Planck-Wissenschaftler in das Erbgut von Viren ein. Diese dienten Hasan und seinem Team als Genfähre, um das genetische Material in die Gehirne von Mäusen einzubringen. Tatsächlich wurde der Proteinkomplex in den Nervenzellen der „infizierten“ Mäuse hergestellt. Und hier funktioniert er nun als Indikator für Calcium: Steigt der Calciumspiegel innerhalb der Zelle an – was bei jedem Aktionspotenzial der Fall ist -, so ändert sich durch Calciumbindung die Gestalt von D3cpv. Dabei rücken die beiden Fluoreszenzproteine CFP und YFP enger zusammen, und die Energieübertragung zwischen CFP und YFP verändert sich.
Zwei-Photonen-Mikroskop im Einsatz
„Um diese Veränderung wahrzunehmen, verwenden wir ein von Winfried Denk entwickeltes Zwei-Photonen-Mikroskop“, erklärt Hasan. Jedes einzelne Aktionspotenzial, das aufgrund eines Reizes aus der Umwelt entsteht, macht sich im Gehirn direkt durch ein gelbes Leuchten bei gleichzeitiger Abnahme des blau ausgestrahlten Lichts bemerkbar. Das Zwei-Photonen-Mikroskop erkennt nun sehr präzise die Koinzidenz der beiden Fluoreszenssignale, und entlarvt eindeutig welche Nervenzellen wann miteinander in Kontakt treten und sich unterhalten.
Damian Wallace sowie Jason Kerr vom Max-Planck-Institut für biologische Kybernetik in Tübingen konnten bestätigen: Gezielte elektrische Aufnahmen der Neuronenaktivität nach dem Auslösen eines Reizes zeigten, dass die Farbwechsel tatsächlich mit dem Abfeuern der Aktionspotenziale übereinstimmen. Hasans Methode gibt also Aufschluss darüber, welche Nervenzellen zu welchem Zeitpunkt miteinander in Kontakt treten. Allerdings ist sie nur anwendbar, wenn die Neuronen Aktionspotenziale mit einer Frequenz kleiner als ein Hertz abfeuern.
Aufschluss über komplexe Denkprozesse
Die Forscher konnten damit zum ersten Mal zeigen, dass genetische Calcium-Indikatoren einen optischen Nachweis über die Wahrnehmungen des sensorischen Systems in höheren Organismen liefern. „Mit dieser Methode können wir genauer verstehen, wie das menschliche Gehirn komplexe Denkprozesse regelt und wie es beispielsweise zahlreichen Sinneseindrücke in langlebige Erinnerungen verwandelt“, so Hasan.
Auch Entwicklungen, die sich durch das Altern der Nervenzellen ergeben, können nachvollzogen werden – „denn nun haben wir die Möglichkeit, die Neuronen über lange Zeiträume hinweg zu beobachten“, fasst Hasan die Ergebnisse zusammen. Die Sensor-Proteine seien zudem gut geeignet, um die zelluläre Ebene von neurologischen Krankheiten wie Alzheimer, Parkinson und Chorea Huntington besser zu verstehen.
(idw – Max-Planck-Gesellschaft zur Förderung der Wissenschaften, 25.09.2008 – DLO)