Der Botenstoff cGMP ist unter anderem bei der Regulation des Blutdrucks und beim Sehvorgang wichtig. Er wird durch Enzyme produziert, deren Funktionsweise und Struktur bisher unklar war. Jetzt haben Forscher deren Form und Wechselwirkungen erstmals analysiert. Sie berichten darüber in der aktuellen Ausgabe der Proceedings of the National Academy of Sciences (PNAS).
Ursprung vieler Krankheiten wie Diabetes und Krebs sind Fehler in der Kommunikation innerhalb von und zwischen Zellen. Sie können unter anderem bei der Benutzung der „second messenger“ entstehen, kleiner Moleküle, die Zellen häufig als Botenstoff zur Signalweiterleitung in ihrem Inneren verwenden. Ein bekannter second messenger ist das zyklische Guanosinmonophosphat (cGMP), das beim Menschen etwa bei der Regulation des Blutdrucks und beim Sehvorgang eine zentrale Rolle spielt. Seine Herstellung obliegt bestimmten Enzymen, den Guanylatzyklasen, die bislang ein Schattendasein fristeten: Da sie schwierig zu gewinnen sind, wusste man wenig über sie.
GCs: Kleine, feine Unterschiede
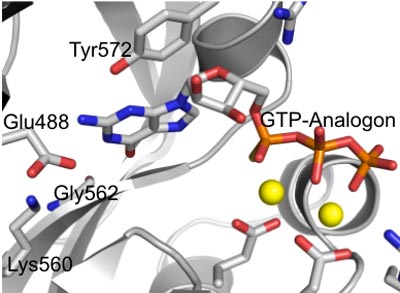
Der Botenstoff cGMP wird von den Guanylatzyklasen (GCs), hergestellt, wenn diese durch ein anderes Signalmolekül angeregt werden, zum Beispiel ein Hormon. Die Bereiche, die für die Herstellung von cGMP verantwortlich sind, sind bei allen bekannten GCs sehr ähnlich. Deutlich verschieden sind aber die Proteinbereiche, die für die Regulation dieser Synthese verantwortlich sind. So reagiert die sogenannte „lösliche GC“, die ein Hauptregulator des Blutdrucks ist, auf Stickstoffmonoxid. Andere GCs, die die Zellmembran durchspannen, können verschiedene Signale außerhalb der Zelle erkennen, z.B. Peptidhormone. Wenn sie durch Bindung des Hormons angeregt werden, „übersetzen“ sie dieses Signal in ein cGMP-Signal innerhalb der Zelle, wo es dann die benötigte Reaktion der Zelle bewirken kann.
Struktur und Funktion waren unbekannt
Genaue Einblicke in die Funktionsweise von GCs waren bisher nicht möglich, da es schwierig ist, sie in ausreichenden Mengen für biochemische und biophysikalische Experimente zu gewinnen. Insbesondere konnte bisher noch keine Struktur einer GC bestimmt werden. Das heißt, dass die genaue räumliche Anordnung der Atome des Proteins, die ein detailliertes Verständnis seiner Funktionsweise erst möglich macht, bisher unbekannt war. Der Arbeitsgruppe von Junior-Professor Clemens Steegborn ist es nun erstmals gelungen, die Struktur einer GC zu bestimmen und grundlegende Mechanismen der cGMP-Bildung zu verstehen.