Damit der Vorgang besonders effizient abläuft und aus einer mRNA zahlreiche Proteine erzeugt werden, reihen sich in der Zelle mehrere Ribosomen zu einem so genannten Polysom aneinander: Im Polysom läuft die mRNA wie am Fließband von einem Ribosom zum nächsten, sodass mehrere Proteine gleichzeitig entstehen. Wie diese Ribosomen-Kette im Detail aussieht, war bisher noch nicht bekannt.
Kryo-Elektronentomographie im Einsatz
Max-Planck-Wissenschaftler um Wolfgang Baumeister und Ulrich Hartl nutzten nun die in Martinsried entwickelte Technik der Kryo-Elektronentomographie, um die Architektur dieser molekularen Fabriken sichtbar zu machen.
Die Kryo-Elektronentomographie ist ein Verfahren mit dem dreidimensionale Strukturen der Zelle direkt untersucht werden können. Der Trick: Die gesamte Zelle bzw. einzelne Zellbestandteile werden blitzartig „schockgefroren“, sodass deren räumliche Struktur erhalten bleibt. Anschließend werden aus vielen verschiedenen Blickwinkeln zweidimensionale elektronenmikroskopische Bilder des Objekts aufgenommen, aus denen dann ein dreidimensionales „Bild“ rekonstruiert wird.
Dicht gepackte Ribosomen
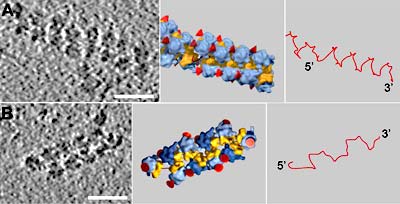
Die Untersuchungen zeigten nach Angaben der Forscher, dass die Ribosomen im Polysom dicht gepackt vorliegen und sich so anordnen, dass bestimmte Bauteile – die so genannten kleinen Untereinheiten – sich zum Inneren des Polysoms hin ausrichten und einander zugewandt sind. Dabei nehmen sie bevorzugt zwei Konfigurationen ein: Entweder liegen die Ribosomen gegeneinander versetzt in einer Ebene – die Untereinheiten liegen „Kopf-an-Kopf“ -, oder sie sind um 180° gegeneinander verdreht (die Untereinheiten liegen „Kopf-an-Ende“).
In beiden Fällen befinden sich mRNA Aus- bzw. Eingang benachbarter Ribosomen nah zusammen, sodass das Botenmolekül ohne große Umwege von einem Ribosom zum nächsten gelangt. Sind alle Ribosomen eines Polysoms in der Kopf-an-Kopf-Konfiguration einander zugewandt, entsteht nach Angaben der Wissenschaftler eine ausgeprägte schraubenartige Struktur. Bei abwechselnder Anordnung mit der Kopf-an-Ende-Konfiguration ergibt sich eine flächige Polysomenstruktur.
Größtmöglicher Abstand
Das Ablesen der mRNA, die wichtige Übertragung der genetischen Information in die Struktur der Proteine, erfolgt geschützt im Innenraum des Polysoms während sowohl die Eingänge durch die die Aminosäuren zu dem Ort in den Ribosomen gelangen, an dem sie verknüpft werden, als auch die Ausgänge für die fertigen Proteine dem Zellraum zugewandt und so leicht erreichbar sind.
„Wir haben mit unserer Strukturaufklärung gezeigt, dass die Anordnung der Polysomen dafür sorgt, dass die in benachbarten Ribosomen erzeugten Proteine den größtmöglichen Abstand voneinander einhalten. So wird verhindert, dass sich neu entstehende Proteine miteinander ‚Verheddern‘ und Verklumpen“, erklärt Hartl.
Neue Aufgabe für die Chaperone
Die bisherige Annahme, hauptsächlich bestimmte Proteine – so genannte Chaperone – wären dafür zuständig, erscheint vor dem Hintergrund dieser Ergebnisse in einem neuen Licht: Möglicherweise dienen sie weniger dazu, ein Zusammenklumpen im Polysom gebildeter Proteine zu verhindern – hiervor schützt ja schon der strukturell bedingte Abstand zwischen den Proteinsträngen.
Vielmehr erfüllen sie den Zweck, fehlerhafte Faltungen innerhalb eines Proteins zu vermeiden und ein Zusammenklumpen mit Proteinen die in anderen Polysomen gebildet wurden, zu verhindern – ein Fehler der in der vollgestopften zellulären Umgebung, wo Polysomen dicht an dicht auftreten, leicht passieren könnte.
(idw – Max-Planck-Institut für Biochemie, 23.01.2009 – DLO)
23. Januar 2009