Hoffnung für Arthrose-Patienten: Forscher haben womöglich einen Weg gefunden, Arthrose künftig effektiver zu behandeln – mithilfe einer sogenannten Nanofähre. Dieses Transportmolekül kann potenzielle Medikamente direkt zu den geschädigten Gelenken bringen und ihnen dabei helfen, tief in das Gewebe vorzudringen. Auf diese Weise können die Mittel besser und länger ihre Wirkung entfalten, wie erste Tierversuche zeigen.
Arthrose ist die weltweit häufigste Gelenkerkrankung: Schätzungsweise 200 Millionen Menschen leiden an dieser durch fortschreitenden Knorpelabbau gekennzeichneten Verschleißerscheinung, die mit starken Schmerzen und Entzündungen einhergeht. Gängige Behandlungsmethoden können bisher nur die Beschwerden lindern – nicht aber das weitere Fortschreiten der Erkrankung verhindern.
Zwar gibt es potenzielle Medikamente, die dem Knorpelabbau entgegenwirken und sogar zu einer Regeneration des geschädigten Gewebes führen könnten. Bisher gelingt es jedoch nicht, diese an die entscheidende Stelle im Körper zu transportieren: die Knorpel-produzierenden Zellen im Gelenk. So scheitern Wirkstoffe in der Regel daran, das dicke Knorpelgewebe zu durchdringen, das diese sogenannten Chondrozyten umgibt.
Zum Ziel transportiert
Wissenschaftler um Brett Geiger vom Massachusetts Institute of Technology (MIT) könnten nun jedoch eine Lösung für dieses Problem gefunden haben: Sie konstruierten eine Nanofähre, die Arthrose-Medikamente verlässlich zum Zielort bringen soll. Ihr Transportmolekül besteht aus sogenannten Dendrimeren, die ausgehend von einem zentralen Kern wie Zweige an einem Baum verästelt sind.
Der Clou: Jeder dieser „Zweige“ ist an seinem Ende positiv geladen – das Molekül kann daher besonders gut an den negativ geladenen Knorpel binden. Die Wirkstoffe, mit denen dieses Molekül beladen wird, bleiben auf diese Weise länger dort, wo sie hingehören, anstatt schnell weggewaschen zu werden. Dies erleichtert ihnen, tief in das Gewebe hinein zu diffundieren und schließlich zu den Chondrozyten vorzudringen.
Deutlicher Vorteil
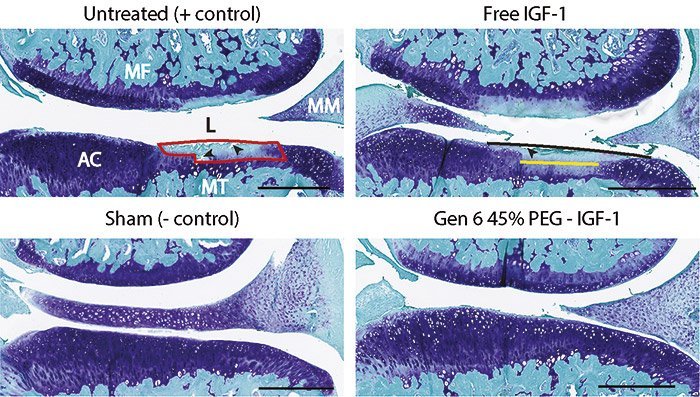
Soweit die Theorie – doch wie sieht es in der Praxis aus? Um das zu testen, beluden die Forscher ihre Nanofähre mit dem Wachstumsfaktor IGF-1. Denn in früheren Studien hatte sich gezeigt, dass diese Substanz die Regeneration von Knorpelgewebe fördert. Für ihren Versuch injizierten Geiger und sein Team die Transportmolekül-Wirkstoff-Kombination in die Kniegelenke Arthrose-kranker Ratten.
Das Ergebnis: Bei den so behandelten Nagern erholte sich der geschädigte Knorpel deutlich besser als bei Tieren, denen der Wachstumsfaktor allein gespritzt worden war. Auch die Entzündungen in den Gelenken gingen merklich zurück. Insgesamt blieb die Wirkstoffkonzentration im Gelenk rund 30 Tage lang hoch genug, um einen therapeutischen Effekt zu erzielen, wie die Wissenschaftler berichten.
„Vielversprechende Ergebnisse“
Das Knorpelgewebe in den Gelenken von Ratten ist mit 100 Mikrometern allerdings deutlich dünner als das von Menschen, das eine Dicke von ein bis zwei Millimetern erreichen kann. Schafft es der Wirkstoff mithilfe der Nanofähre auch, solche größeren Hindernisse zu überwinden? Dies untersuchte das Team an Knorpelgewebe von Kühen, das ähnlich dick wie das menschliche Pendant ist.
Und tatsächlich: Innerhalb von zwei Tagen hatte das Medikament das Gewebe penetriert. „Wir haben damit nun einen Weg gefunden, direkt zu den geschädigten Zellen vorzudringen und dort unterschiedliche Therapeutika einzusetzen“, sagt Geigers Kollegin Paula Hammond. „Dies sind sehr vielversprechende Ergebnisse“, kommentiert auch der nicht an der Untersuchung beteiligte Christopher Evans von der Mayo Clinic in Rochester.
Bevor das neue Verfahren aber in der klinischen Praxis zum Einsatz kommen kann, müsse sein Potenzial zunächst in weiteren Studien mit größeren Tieren und schließlich menschlichen Patienten bestätigt werden. (Science Translational Medicine, 2018; doi: 10.1126/scitranslmed.aat8800)
Quelle: American Association for the Advancement of Science, Massachusetts Institute of Technology