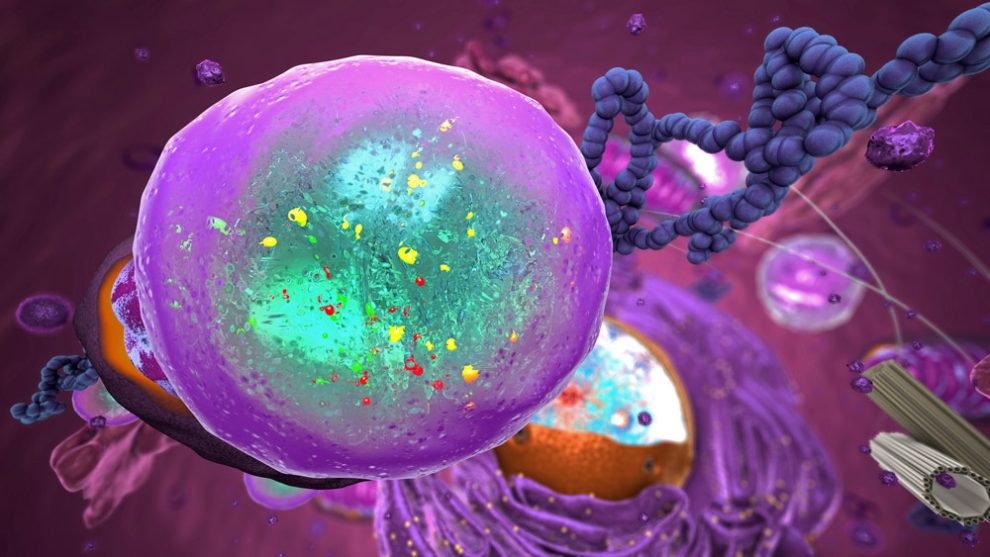
Lysosomen sind die wichtigsten Akteure der zellulären Abfallentsorgung. Jetzt enthüllen Analysen, dass diese winzigen Abbaubläschen je nach Gewebe und Zelltyp sehr unterschiedlich zusammengesetzt sind. So kommen beispielsweise in den Lysosomen der Leberzellen andere Proteine vor als in Nierenzellen oder in Zellen von Krebstumoren. Die Proteinausstattung der Lysosomen kann daher wertvolle Einblicke in die zellulären Wurzeln bestimmter Krankheiten geben.
Die Entsorgung defekter oder krankhafter Zellbestandteile ist für unsere Zellen überlebenswichtig. Zentraler Teil der zellulären Müllabfuhr sind dabei die Lysosomen – von einer Lipidmembran umgebene Bläschen im Cytoplasma, in denen Dutzende verschiedener Enzyme die eingeschleusten Abfallstoffe in ihre Einzelteile zerlegen. Die von den Lysosomen erzeugten Abbauprodukte können dann der Zelle wieder als Rohstoff für weitere Zellprozesse dienen.
„Der Prozess ist immens wichtig“, erklärt Seniorautor Dominic Winter vom Universitätsklinikum Bonn. „Wenn er nicht korrekt funktioniert, können Erkrankungen wie Alzheimer oder Parkinson die Folge sein.“ Auch für den Energiestoffwechsel der Zelle, die Erregerabwehr oder Reparaturmechanismen sind die Lysosomen und ihre Abbautätigkeit von entscheidender Bedeutung. Entsprechend komplex sind sie aufgebaut: Wenn man Lysosomen aus Zellen isoliert, findet man oft mehr als 5.000 unterschiedliche Proteine.
Bestandsaufnahme der Lysosomen-Proteine
Doch welche Funktion diese Proteine im Einzelnen haben und wie viele davon wirklich an der Abbautätigkeit der Lysosomen beteiligt sind, ließ sich bisher schwer ermitteln. „Es kann sich auch um Moleküle handeln, die gerade in ihnen zerlegt werden“, erklärt Winter. „Andere hängen vielleicht von außen an ihrer Membran, ohne irgendeine Aufgabe zu erfüllen. Und auch bei der Isolierung der Lysosomen gibt es meist eine Menge unerwünschten Beifang.“
Deshalb haben Winter, Erstautorin Fatema Akter von der Universität Bonn und ihr Team ein Verfahren entwickelt, mit dem sich unbeteiligte Moleküle von echten Lysosomen-Proteinen besser unterschieden lassen. Für ihre Studie wendeten sie diese Analysenverfahren an sechs verschiedenen Zelllinien an, vier vom Menschen und zwei von der Maus. Die humanen Zellkulturen stammten aus der Niere, dem Gebärmutterhals, der Leber sowie dem Knochenmark und waren teilweise aus Krebstumoren entnommen worden.
Ausstattung je nach Zelltyp unterschiedlich
Die Analysen ergaben: Von den 5.000 Proteinen sind gut 1.000 enger mit der Funktion der Lysosomen verknüpft. Von diesen Proteinen kamen einige hundert in fast allen Lysosomen vor – egal, aus welchem Gewebe diese stammten. Darüber hinaus gibt es jedoch viele Proteine, die nur in den Lysosomen bestimmter Gewebe vorzukommen scheinen. Andere Proteine wiederum unterscheiden sich je nach Zelltyp in ihrem Anteil und ihrer Menge.
„In jedem der sechs Zelltypen, die wir untersucht haben, haben die Lysosomen eine ganz spezifische Protein-Ausstattung“, berichtet Winter. „Wir sind meines Wissens die erste Arbeitsgruppe, die das zeigen konnte.“ Die Entsorgungsfabriken der Zellen sind demnach je nach Gewebe und Zelltyp spezifisch aufgebaut und verfügen über eine jeweils eigene, an die Bedürfnisse der Zellen angepasste Ausstattung an Proteinwerkzeugen.
Mehr Abbau-Enzyme in der Leber, mehr Transporter in Krebszellen
„Die Lysosomen von Leberzellen sind zum Beispiel randvoll mit Abbau-Enzymen“, berichtet Winter. „Das ist auch plausibel – eine wichtige Funktion der Leber ist die Zerlegung unterschiedlicher Moleküle.“ Denn die Leber spielt eine wichtige Rolle für die Entgiftung des Körpers. Krebszellen verfügen dagegen über eine Spezialvariante von Lysosomen, die sie besonders effektiv mit Bausteinen für ihren Energiestoffwechsel versorgen kann. „In den von uns untersuchten Krebszellen enthielten die Lysosomen sehr viele Transporter-Proteine““, berichtet Winter.
Der Grund dafür: Tumore benötigen für ihr Wachstum viel Energie, gleichzeitig sind sie oft schlecht durchblutet. Sie verdauen daher das umgebende Gewebe mithilfe der Lysosomen und nutzen die Abbauprodukte für ihre Energiegewinnung. Damit diese dann von der Krebszelle genutzt werden können, müssen sie aus den Lysosomen zurück in die Zelle transportiert werden – daher die vielen Transporter-Proteine.
Hinweise auf zelluläre Wurzeln von Parkinson und Co
Insgesamt tragen die Ergebnisse dazu bei, mehr über die Funktion und Arbeitsweise der Lysosomen ans Licht zu bringen. Sie könnten aber auch dazu beitragen, die Rolle der Lysosomen bei bestimmten Krankheiten zu erhellen. So sind einige Erbkrankheiten bekannt, die auf der Fehlfunktion der Lysosomen beruhen. Zudem mehren sich in den letzten Jahren die Indizien dafür, dass die zellulären Abbaufabriken auch an Krebs und neurodegenerativen Erkrankungen beteiligt sein könnten.
So weiß man seit längerem, dass bei der Parkinson-Erkrankung die Lysosomen in bestimmten Nervenzellen verändert sind. „Wir können nun eine Art Protein-Fingerabdruck dieser Lysosomen nehmen und mit dem von Gesunden vergleichen“, erläutert Winter. „Das könnte Hinweise darauf geben, wie die Funktion der zellulären Schredder bei Betroffenen verändert ist und warum das zu neurologischen Problemen führt.“ Langfristig könnte das auch helfen, neue Ansatzpunkte für Medikamente zu finden. (Molecular & Cellular Proteomics, 2023; doi: 10.1016/j.mcpro.2023.100509)
Quelle: Universität Bonn