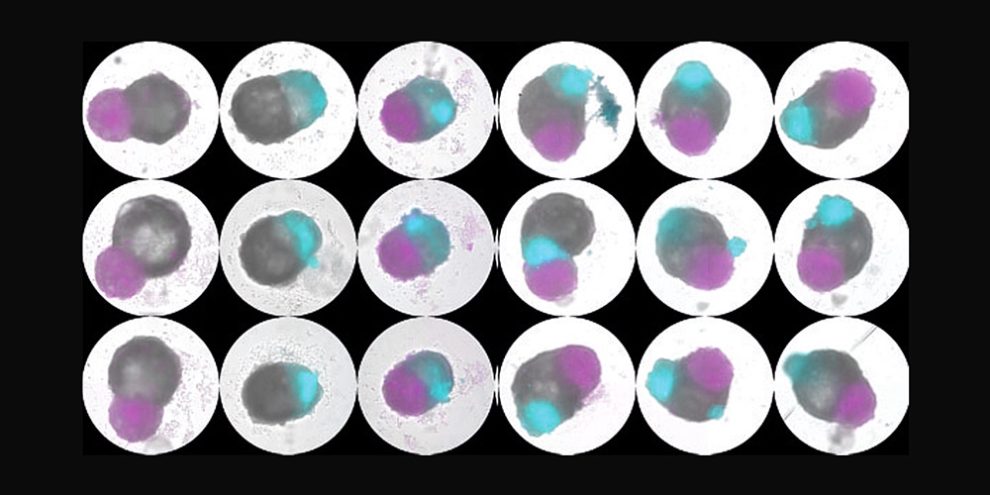
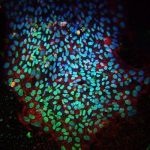
Herz im Miniformat: Einem Forschungsteam ist es erstmals gelungen, ein Organoid des menschlichen Herzens mit mehreren Herzkammern zu generieren. Das Mini-Organ umfasst den linken Vorhof sowie beide Herzkammern. Damit bildet es die komplizierten Strukturen unseres Herzens besser nach als frühere Modelle und hilft zu erforschen, wie Defekte und Erkrankungen unseres Herzens entstehen und welche Medikamente gegen die Herzleiden helfen könnten.
Wissenschaftler versuchen schon seit längerem, verschiedene Organe und ihre Vorform, sogenannte Organoide, im Labor zu züchten, um daran die Funktionsweise, aber auch Organdefekte zu erforschen. Solche dreidimensionalen Zell-Modelle gibt es beispielsweise bereits für unsere Haut, Nieren und Muskeln. Doch von unserem Herzen lagen bislang nur sehr einfache Organoide vor. Zwar gelang es 2019 erstmals, ein komplettes Mini-Herz mit dem 3D-Drucker zu erzeugen, dieses konnte aber nicht koordiniert schlagen.
Weil bei Erkrankungen zudem unterschiedliche Bereiche des Herzens betroffen sind, braucht die Forschung ein Modell, das auch verschiedene Herzareale enthält. „Während die meisten Krankheiten bei Erwachsenen die linke Herzkammer betreffen, die sauerstoffreiches Blut durch den Körper pumpt, betreffen angeborene Defekte vor allem andere Herzregionen, die für den Aufbau und die Aufrechterhaltung der Durchblutung unerlässlich sind“, erklärt Seniorautor Sasha Mendjan vom Institut für Molekulare Biotechnologie der Österreichischen Akademie der Wissenschaften (IMBA).
Organoide von Herzkammern entwickelt
Das Forschungsteam um Mendjan arbeitet daher schon seit längerem an komplexeren Herzorganoiden, sogenannten Cardioiden. In einer früheren Studie hatte das Team aus menschlichen Stammzellen bereits ein Herzorganoid hergestellt, das der linken Herzkammer in einem sehr frühen Embryonalstadium ähnelte. Nun haben Mendjan, Erstautorin Clara Schmidt vom IMBA und ihr Team diese Organoide gezielt weiterentwickelt.
Dafür züchteten die Forschenden zunächst entsprechende Cardioide von allen wichtigen Strukturen des menschlichen Herzens: der Vorhof-Region, den beiden Herzkammern sowie den Strukturen für ihren Blutzu- und -abfluss. Diese Zellmodelle stellen jeweils frühe Entwicklungsstufen der rechten Herzkammer, der Vorhöfe sowie der Ein- und Ausgangsbereiche der beiden Herzkammern dar. Diese Organoide erzeugten Schmidt und ihre Kollegen zunächst getrennt voneinander.
Kombination mehrerer Herzbereiche
Im nächsten Schritt versuchte das Team, auf dieser Basis ein kombiniertes Herzorganoid mit mehreren Kammern zu bilden, das wie das frühe menschliche Herz bei Embryonen koordiniert schlägt. Dafür ließen Schmidt und ihre Kollegen die einzelnen Organoide für linke und rechte Herzkammer sowie einen Vorhof gemeinsam entwickeln und zusammenwachsen.
Mit Erfolg: Das Ergebnis ist ein Herzorganoid aus zwei Herzkammern und einem Vorhof, das koordiniert schlägt. „Tatsächlich breitete sich ein elektrisches Signal vom Vorhof zur linken und dann zur rechten Ventrikelkammer aus – genau wie bei der frühen fetalen Herzentwicklung bei Tieren“, sagt Mendjan. „Wir haben diesen grundlegenden Prozess nun erstmals in einem menschlichen Herzmodell mit all seinen Kammern beobachtet“, ergänzt er.
Wie entsteht der Rhythmus unseres Herzens?
Mit dem neuen Drei-Kammer-Cardioid-Modell können Forschende nun die Organisation des Herzgewebes innerhalb einzelner Bereiche detaillierter untersuchen. Außerdem können sie jetzt genauer nachvollziehen, warum sich die Kammern in ihrem typischen Rhythmus abwechselnd zusammenziehen und so den Herzschlag bilden. Neue Hinweise darauf, wie unser Herz seinen Rhythmus findet, haben Schmidt und ihre Kollegen bereits gefunden.
Demnach gab bei der Entwicklung zunächst die linke Herzkammer den Rhythmus der rechten Herz- und Vorhofkammer vor. Zwei Tage später folgten die beiden Kammern hingegen der Führung des Vorhofs. „Das spiegelt wider, was man bei Tierherzen sieht, bevor die späteren Anführer, die spezialisierten Schrittmacherzellen, den Herzrhythmus kontrollieren“, erklärt Koautorin Alison Deyett vom IMBA.
Wie entstehen Herzfehler bei menschlichen Embryonen?
Über die grundlegenden Antworten hinaus hat das neue Herzmodell auch therapeutischen Nutzen: Anhand der Organoide kann künftig deutlich schneller untersucht werden, wodurch Fehlbildungen des Herzens beim Embryo hervorgerufen werden. Dafür entwickelte das Team um Schmidt eine Screening-Plattform, mit der hunderte Organoide gleichzeitig analysiert werden können.
Um zu testen, ob die Plattform zuverlässig funktioniert, setzten die Wissenschaftler Genmutationen und Chemikalien ein, die bekanntermaßen Missbildungen des Herzens bei Föten fördern. Damit wiesen sie nach, dass diese Fehlbildungen auch in den Organoiden ihrer Plattform auftreten. In Zukunft kann mit der Technik nun die Wirkung vieler weiterer chemischer Substanzen, Genveränderungen und Umwelteinflüsse auf die Entwicklung des Herzens getestet werden.
„Unsere Tests zeigen, dass Cardioide mit mehreren Kammern die embryonale Herzentwicklung nachempfinden und störende Auswirkungen auf das gesamte Herz mit hoher Spezifität aufdecken können“, berichtet Mendjan. So soll die individuelle Ursache von Herzfehlern gefunden werden.
Neue Medikamente gegen Herzerkrankungen möglich
Zudem können die neuen Organoide genutzt werden, um diese Defekte im Herzen zu lokalisieren und dadurch bessere Medikamente gegen häufige Herzerkrankungen zu entwickeln. Denn Herz-Kreislauf-Erkrankungen sind die weltweit häufigste Todesursache und etwa jedes 50. Kind wird bereits mit einem Herzfehler geboren. Anders als frühere Präparate sollen die künftigen Arzneimittel spezifisch auf die betroffenen Herzbereiche wirken, zum Beispiel die Vorhöfe. „Vorhofrhythmusstörungen sind weit verbreitet, aber wir haben derzeit keine guten Medikamente, um sie zu behandeln“, erklärt Mendjan.
Bei der Suche nach neuen Präparaten könnten in Zukunft auch personalisierte Herzorganoide zum Einsatz kommen, die aus Stammzellen von Patienten hergestellt wurden, berichten die Wissenschaftler. Dadurch könnten individuelle Medikamente entwickelt werden. Um neue Arzneimittel zur Behandlung verschiedener Formen der Herzinsuffizienz bei uns Menschen zu finden, haben sich die Forschenden ihre Technologie der Herzorganoide mit mehreren Kammern bereits patentieren lassen und mit ihrem Spin-off-Unternehmen HeartBeat.bio AG eine entsprechende vollautomatische Forschungsplattform generiert.
Modell stellt nicht unser gesamtes Herz dar
Insgesamt stellt das neu entwickelte Modell aber nicht noch das gesamte menschliche Herz dar, sondern ein frühes und vereinfachtes Entwicklungsstadium unseres Herzens. Nicht berücksichtigt ist beispielsweise, wie sich Herzklappen und die Koronargefäße bilden, und allgemein, wie das Herz wächst und reift. Die Organoide können daher keine Herzdefekte aufdecken, die zu einem späteren Zeitpunkt auftreten, berichten die Forschenden. (Cell, 2023; doi: 10.1016/j.cell.2023.10.030)
Quelle: Institut für Molekulare Biotechnologie der Österreichischen Akademie der Wissenschaften (IMBA)