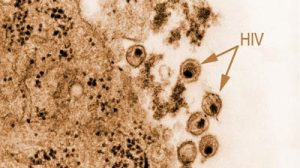
Nach einer HIV-Infektion schleust das Virus sein Erbmaterial in das der Wirtszelle ein. Diese stellt Kopien her, liest die Viren-RNA ab und stellt nach diesem Bauplan Virenproteine her. Komplette Viren werden freigesetzt und befallen die nächsten Zellen. Ein Forscherteam hat jetzt einen möglichen Ausgangspunkt für einen neuen Wirkstoff entwickelt, der in diesen todbringenden Zyklus eingreifen soll.
{1r}
Wie in der Zeitschrift Angewandte Chemie berichtet, handelt es sich dabei um ein haarnadelförmiges Molekül, das die räumliche Struktur eines wichtigen viralen Proteins nachahmt und so das Ausschleusen der Virus-RNA aus dem Zellkern stoppen soll.
Furche auf der RNA
Ein wichtiger Schritt im Lebenszyklus von HIV – und neuer interessanter Ansatzpunkt für eine Therapie: Die im Kern der Wirtszelle nachgebaute Viren-RNA wird als langer Strang durch die Poren der Kernmembran in das Zytoplasma der Zelle hinaustransportiert, um dort in Proteine übersetzt oder in eine Virenhülle verpackt zu werden. Dieses Ausschleusen ist ein aktiver Vorgang, der durch ein bestimmtes, Rev genanntes Virenprotein vermittelt wird. Viele Einheiten von Rev müssen dazu an eine Bindestelle auf der Viren-RNA binden, die Rev Responsive Element (RRE) genannt wird. Die Suche nach effektivem RRE-bindenden Inhibitor blieb bisher allerdings erfolglos.
Es ist eine kleine argininreiche Domäne aus 17 Aminosäuren, die das Rev-Protein seine Bindestelle, eine Furche auf der RNA, erkennen lässt. An die RNA gebunden, weist diese Domäne eine helikale Form auf. Dieses Proteinstückchen wollte das Forscherteam um John A. Robinson und Gabriele Varani nachbauen, um die Bindung von Rev an RRE zu stören.
Viel versprechende neue Wirkstoffklasse
Sie stellten ein Peptidmimetikum her, ein Molekül, das die Struktur des gewünschten Peptids nachahmt. Wie die Gruppe bereits zuvor zeigen konnte, lassen sich alpha-helikale Peptide durch eine so genannte beta-Haarnadelschleife gut nachahmen. An das robuste Gerüst der „Haarnadel“ werden Seitengruppen so angeknüpft, dass sie die für eine molekulare Erkennung wichtigen Atomgruppierungen räumlich genauso präsentieren wie das beim Vorbild, dem helikalen Peptid, der Fall ist.
In mehreren Screeningstufen wurde, ausgehend von einer kleinen Familie zyklischer Haarnadel-Peptidmimetika, nach und nach eine Struktur entwickelt, die fest und recht spezifisch an RRE bindet und in der Lage ist, das Rev-Protein aus Rev-RRE-Komplexen zu verdrängen.
„Haarnadel-Peptidmimetika sind eine viel versprechende neue Wirkstoffklasse“, sagt Robinson. „Wir hoffen, dass sich auf dieser Basis ein Wirkstoff entwickeln lässt, der sich für die HIV-Therapie eignet.“
(idw – Gesellschaft Deutscher Chemiker, 31.10.2007 – DLO)