Sie stecken in der Antihaft-Beschichtung unserer Pfannen, in Katalysatoren und in hochfestem Stahl – und eigentlich dürfte es sie gar nicht geben. Denn die Quasikristalle widersprechen den festen Regeln der Kristallstruktur. Statt der regelmäßigen, immer gleichen Grundeinheiten wechseln sich in ihrem Gitter Einheiten mit unterschiedlicher Symmetrie ab – ähnlich wie die fünfeckigen und sechseckigen Lederstücke bei einem Fußball.

Beugungsmuster von Shechtmans Quasikristall © Nobel Foundation
Verblüffendes Muster
Kein Wunder, dass der US-Chemiker Daniel Shechtman im April 1982 seinen Augen kaum traute, als er das Beugungsmuster seiner neuesten Materialprobe sah: Die schnell abgekühlte Schmelze aus Aluminium und Mangan zeigte ein „unmögliches“ Gittermuster. Zu sehen waren konzentrische Ringe aus jeweils zehn hellen Flecken, die auf eine Fünffach-Symmetrie im Material hindeuteten.
Doch eine solche Symmetrie galt bei einem Kristall als unmöglich. Weil einige Atome näher zusammenliegen müssten als andere wäre eine periodische Wiederholung des immer gleichen Musters damit nicht möglich – und damit eine der Grundregeln der Kristallographie verletzt. Als Shechtman seine Ergebnisse Kollegen und Vorgesetzten vorstellte, glaubten diese an methodische Fehler. Als er darauf beharrte, dass seine Messungen stimmten, drohten sie ihm sogar mit Herauswurf aus seiner Arbeitsgruppe. Auch ein Fachartikel über seine Entdeckung wurde abgelehnt.
Wie die Kacheln des Penrose-Parketts
Shechtman war jedoch nicht der einzige, der ab und zu auf seltsam regelmäßig-unregelmäßige Substanzen stieß. Auch andere Physiker und Chemiker beobachteten ab und zu ähnlich verwirrende Beugungsmuster mit zehn und mehr konzentrischen Punkten. Sie schrieben dies aber Messfehlern oder zu Doppelkristallen verwachsenen Proben zu.
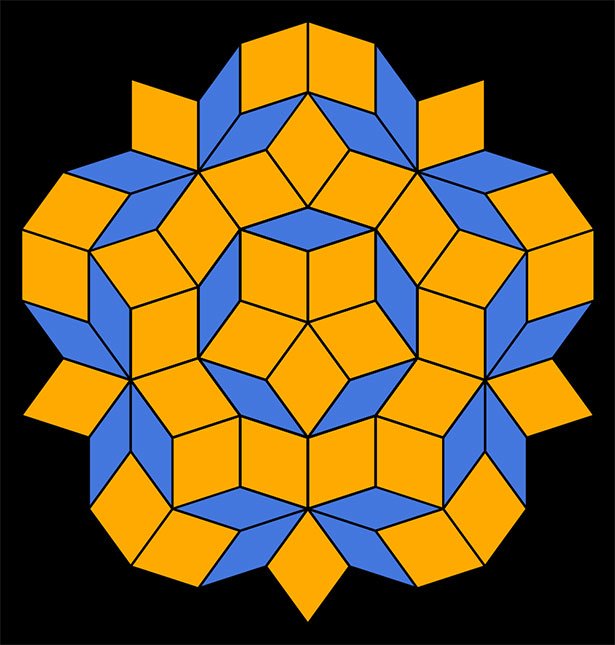
Ein typisches Penrose-Muster aus zwei verschieden breiten Rauten. © gemeinfrei
Dass diese Forscher keineswegs irrten, klärte sich erst, als zwei Physiker dieses Phänomen aus mathematischer Sicht analysierten. Ihnen fiel auf, dass die Gittermuster der Penrose-Parkettierung ähnelten – einem Kachelmuster, bei dem sich verschieden geformte Kacheln in periodischer Abfolge wiederholten. Aus zwei verschieden dicken Rauten kann so ein durchaus regelmäßiges Muster entstehen.
Genauso funktioniert auch die Struktur der Quasikristalle: Einheiten unterschiedlicher Form und Symmetrie wechseln sich im dreidimensionalen Gitter ab. Es entsteht so ein durchaus regelmäßiges Gitter, aber eben mit mehr als nur einer Elementarzelle und Symmetrie. Im Jahr 2011 erhielt Daniel Shechtman für seine Entdeckung der Quasikristalle den Nobelpreis für Chemie. Inzwischen werden in Labors und Fabriken weltweit Quasikristalle ganz unterschiedlicher Struktur längst routinemäßig erzeugt. Ihre besondere Symmetrie macht diese Stoffe besonders widerstandsfähig.

Gesteinsprobe mit wnizigen Anteilen des Quasikristalls Icosahedrit (Al63Cu24Fe13) © Steinhardt und Bindi / Rep.Prog. Phys.
Fund im Meteoriten
Offen blieb aber zunächst die Frage, ob diese „unmöglichen“ Kristalle reine Kunstprodukte sind oder ob sie vielleicht doch in der Natur vorkommen. Eine Antwort lieferte erst vor wenigen Jahren ein glücklicher Zufall: Als Paul Steinhardt von der Princeton University und seine Kollegen einen in Sibirien gefundenen Meteoriten untersuchten, stießen sie in einer der Proben auf ein winziges Bröckchen mit ungewöhnlicher Kristallstruktur – einem icosahedrischen Quasikristall.
Seither haben Forscher in weiteren Bröckchen dieses Meteoriten untersucht und noch zwei weitere Quasikristalle entdeckt. Der eine ähnelt einem Stapel von zehneckigen Scheibchen aus Aluminium, Nickel und Eisen, der andere bildet ein Mineral aus Aluminium, Kupfer und Eisen und ähnelt in seiner Form einem 20-seitigen Spielwürfel.
Die Tatsache, dass diese drei natürliche Quasikristalle alle aus einem Meteoriten stammen, spricht dafür, dass sie eine eher seltene Spielart der Natur sind. Die Forscher vermuten, dass erst eine Kollision des Asteroiden im All die extremen Bedingungen schuf, unter denen diese „unmöglichen“ Kristalle entstehen können.
Nadja Podbregar
Stand: 13.01.2017