Der Fehler eines Nobelpreisträgers trug wahrscheinlich sogar dazu bei, eine entscheidende Entdeckung hinauszuzögern. Denn durch seine vermeintlichen Belege glaubte man mehr als ein Jahrzehnt lang, dass sich der entscheidende Code des Lebens in den Proteinen versteckt, statt in RNA und DNA.

Nobelpreisträger Wendell Meredith Stanley © nobelprize.org
Aus was bestehen Viren?
Ende der 1930er Jahre trieb vor allem eine Frage viele Biochemiker um: Wo verbirgt sich der Schlüssel des Lebens – der Code, der dafür sorgt, dass Kinder ihren Eltern ähnlich sind und ein Bakterium dem anderen gleicht? Gleichzeitig grübelten Mediziner darüber nach, was die wahre Natur der erst neu entdeckten Viren sein könnte: Handelte es sich trotz ihrer minimalen Größe um Lebewesen? Oder waren es doch bloße Moleküle?
„Die Tatsache, dass Viren in Bezug auf ihre Größe mit den Organismen des Biologen auf der einen Seite und mit Molekülen des Chemikers auf der anderen Seite überlappen, trug nur noch zum Mysterium ihrer Natur bei“, konstatierte der US-Forscher Wendell Meredith Stanley in seinem Nobelpreis-Vortrag 1946. „Es war nicht bekannt, ob sie anorganisch waren, aus Kohlenwasserstoffen oder Kohlenhydraten bestanden, aus Fetten, Proteinen oder gar organismisch waren.“
Infektiöse Kristalle aus Protein
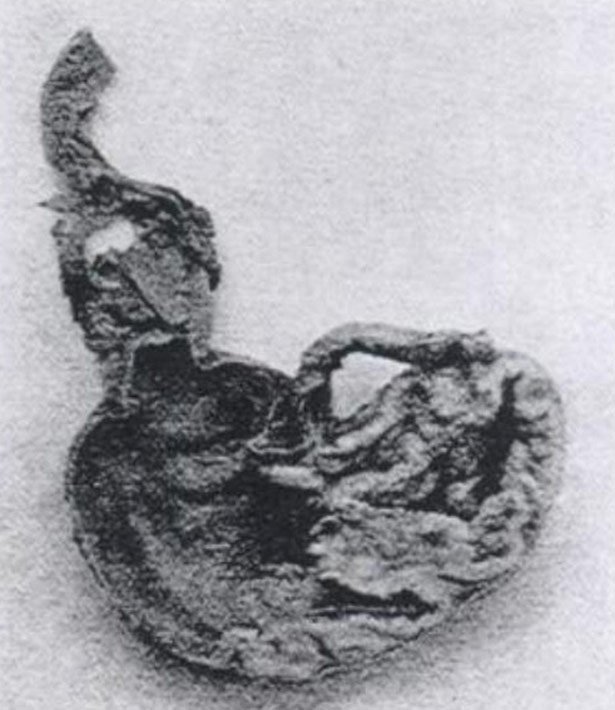
Für Stanley war dies der Anlass, an einer Methode zu forschen, mit der sich die Zusammensetzung von Viren herausfinden ließe. Mitte der 1930er Jahre gelang es ihm, Tabakmosaikviren (TMV) in eine kristalline Form zu überführen. Diese Kristalle, so glaubte Stanley, bestanden aus reinem Virenprotein. Das Entscheidende aber: Als der Forscher Tabakpflanzen mit diesen Kristallen infizierte, brach die Mosaikkrankheit bei ihnen aus.
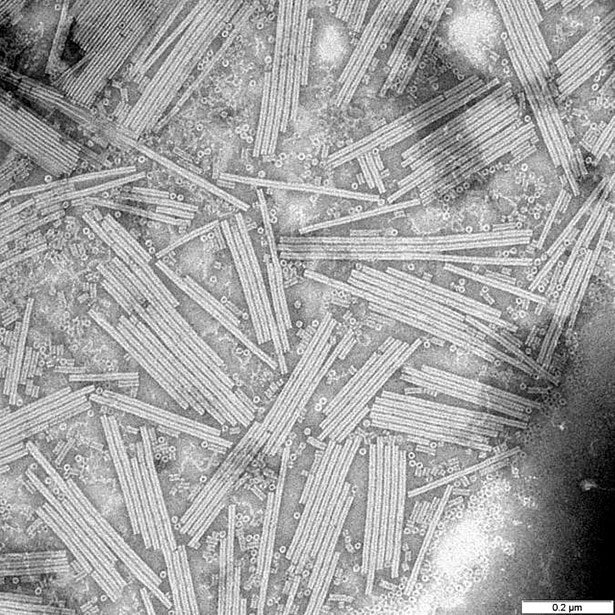
Kristalle des Tabakmosaikvirus © gemeinfrei
„Es wurde festgestellt, dass die gesamte Virusaktivität, die in der infektiösen Lösung enthalten ist, in Form des kristallinen Materials isoliert werden kann,“, so Stanley. Das war ein enormer Durchbruch, schien es doch zu belegen, dass Viren aus Proteinen bestehen – und dass die entscheidenden Informationen für ihre Vermehrung und sogar für Mutationen in diesen Proteinen enthalten sind.
“ Beginn der Molekularbiologie“
1946 erhielt Stanley für seine Erkenntnisse zu den Eigenschaften des kristallisierten Tabakmosaikvirus den Nobelpreis für Chemie. „Seine Entdeckung wurde – durchaus mit einiger Berechtigung – als der symbolische Beginn der Molekularbiologie angesehen“, kommentierte 40 Jahre später die Biochemikerin Lily Kay von der Johns Hopkins University in Baltimore.
Stanley hatte eindrucksvoll die gängige Lehrmeinung seiner Zeit widerlegt, nach der nur lebende Organismen wie Bakterien als Krankheitserreger wirken können. Seine Kristallisation der Viren und genaue Beschreibung ihrer Eigenschaften bewies, dass sie definitiv keine lebenden Zellen waren. Das bedeutet, dass auch molekulare Konstrukte infektiös sein konnten.
…mit kleinen Fehlern
„Dennoch war Stanley Arbeit mit technischen Irrtümern und Fehlschlüssen behaftet“, betont Kay. Denn was Stanley nicht bemerkt hatte: Seine vermeintlich reinen Proben der Virenkristalle waren nicht rein. Sie enthielten auch sechs Prozent Viren-RNA – und damit den eigentlichen Träger der Erbinformation des Tabakmosaikvirus. Weil Stanley dies jedoch nicht wusste, sah er zunächst in den Proteinen die entscheidenden Träger der Infektiosität und Virenaktivität.

Dass die DNA der wahre Träger der Erbinformation ist, setzte sich erst Anfang der 1950er Jahre durch © iStock.com
In der Folge konzentrierte man sich daher bei der Suche nach dem Code des Lebens auf die Proteine. Selbst als der kanadische Mediziner Oswald Avery 1944 durch einen Versuch nachwies, dass Bakterien Erbinformationen in Form von DNA übertragen, konnte er sich zunächst nicht gegen die vorherrschende Meinung durchsetzen. Dies änderte sich erst Anfang der 1950er Jahre, als Alfred Hershey und Martha Chase belegten, dass Bakteriophagen sich in ihren Wirten mittels DNA vermehren.
Damit war klar, dass nicht Proteine, sondern die Nukleinsäuren DNA und RNA die Träger der Erbinformation vieler Viren und auch aller anderen Organismen sein mussten. 1953 beschrieben James Watson und Francis Crick dann erstmals die Struktur der DNA und eröffneten damit endgültig das Zeitalter der DNA.
Nadja Podbregar