Mit dem Beginn des 20. Jahrhunderts überschlagen sich die Ereignisse. Immer mehr Experimente liefern neue Erkenntnisse über die Bausteine der Materie – und die Physiker und Chemiker kommen kaum hinterher, entsprechende Erklärungen und Modelle für das Gefundene zu entwickeln. Vorreiter und Zentrum des Geschehens ist dabei England.

Thomsons Vorstellung des Atoms: eine positive Matrix mit darin eingebetteten Elektronen © MMCD
An der Universität Cambridge ist es der Physiker Joseph John Thomson, der schon kurz vor der Jahrhundertwende als erster eindeutig nachweist, dass Atome – entgegen der Vorstellungen von Dalton und Demokrit – keine massive, unteilbare Einheit sind. Es gelingt ihm zu beweisen, dass Kathodenstrahlen aus Elektronen und damit aus geladenen, subatomaren Teilchen bestehen. Seine Vermutung: Diese von der positiven Elektrode abgestrahlten Elektronen müssen aus den Atomen selbst stammen. Weil aber das Atom als Ganzes neutral ist, muss zusätzlich zu den negativ geladenen Elektronen auch noch ein positiver Rest existieren.
Wie Rosinen in einem Teig
Ausgehend von dieser Überlegung entwickelt Thomson 1903 sein „Rosinenkuchen“-Modell des Atoms: Nach diesem besteht ein Atom aus einer positiven Grundmasse, in das die Elektronen wie winzige Rosinen in einem Kuchenteig eingebettet sind. Die Elektronen, so postuliert der Forscher, können – beispielsweise im Rahmen chemischer Reaktionen – aus der Grundmasse entfernt werden.
Einem Natrium-Atom fehlt dann beispielsweise in einer Kochsalzlösung (Natriumchlorid) ein Elektron, dadurch wird es einfach positiv geladen und wandert beim Anlegen einer Spannung an den negativen Pol, die Anode. Durch dieses Modell kann Thomson die Ladungsveränderungen der Atome bei Reaktionen plausibel erklären. Tatsächlich liegt er mit seinem Grundprinzip – es werden Elektronen ausgetauscht – absolut richtig, wenn auch nicht in der Form.
Auch seine Zeitgenossen kann Thomson damit zunächst vollauf überzeugen. Für seine Entdeckung des Elektrons erhält er 1906 den Nobelpreis für Physik. Im gleichen Jahr kann er nachweisen, dass Wasserstoff nur genau ein Elektron enthält. Der junge Niels Bohr, zu diesem Zeitpunkt noch Student an der Universität Kopenhagen, bezeichnet Thomson damals als „das Genie, das allen den Weg zeigte.“
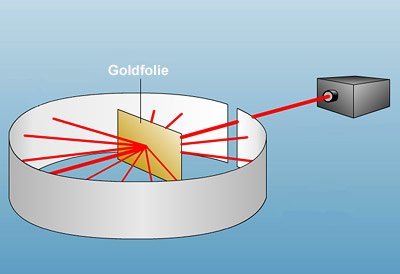
Ruhterfords Streuversuch: Ein Strahl aus Heliumkernen trifft auf eine Goldfolie, ein Schirm registriert, ob und wie die Heliumkerne abgelenkt werden. © MMCD
„Kuchenteig“ unter Beschuss
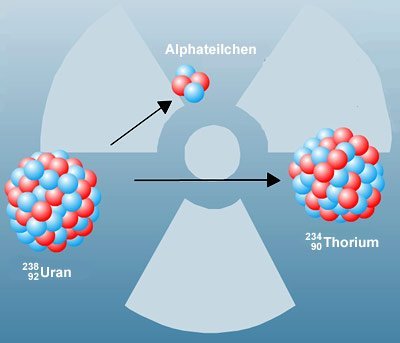
Doch schon wenig später gerät Thomsons „Rosinenkuchen“ unter Beschuss – buchstäblich. Denn in Manchester führt der Physiker Ernest Rutherford 1911 ein Experiment durch, mit dem er Thomsons neues Atommodell überprüfen will. Dazu beschießt er eine dünne Goldfolie mit Alphastrahlen. Diese beim radioaktiven Zerfall von Uran entstehenden Partikel sind, das weiß Rutherford bereits, positiv geladen. Es handelt sich um Heliumatome, die ihrer beiden Elektronen beraubt wurden.
Rutherfords Erwartung: Stimmt das Rosinenkuchen-Modell von Thomson, dann müsste die positive Matrix der Goldatome die auftreffenden positiven Teilchen nahezu vollständig reflektieren. Nur sehr wenige Alpha-Partikel dürften die Folie passieren. Doch zur großen Überraschung des Physikers ist das Gegenteil der Fall: Der größte Teil der Alphateilchen passiert die immerhin rund 4.000 Atomlagen dicke Goldfolie völlig ungehindert. Weniger als ein Prozent der Teilchen wird abgelenkt oder zurückgeworfen.
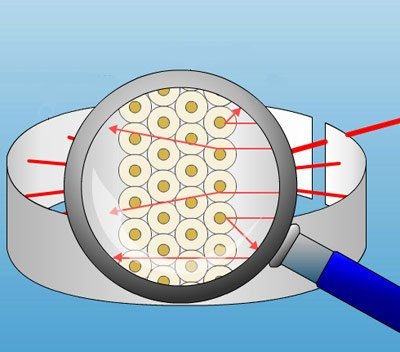
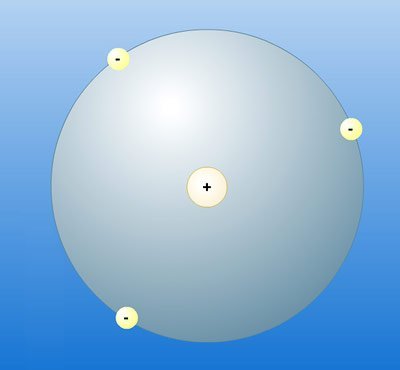
Rutherfords Modell: kleiner postiver Atomkern und große, weitgeend leere Hülle mit Elektronen © MMCD
Leere Hülle und massiver Kern
Für Rutherford ist die Konsequenz aus diesem Ergebnis klar: Das Atom kann kein Rosinenkuchen sein, wie es Thomson postuliert hatte. Stattdessen muss es vorwiegend aus etwas anderem bestehen – aus Leere. Denn nur dann ist erklärbar, warum die Alphateilchen die Goldfolie so mühelos durchschlagen konnten.
„Ich gehe davon aus, dass das Atom aus einem kleinen positiv geladenen Atom besteht, in dem praktisch die gesamte Masse des Atoms konzentriert ist. Um diesen Kern verteilen sich Elektronen, die das Atom elektrisch neutral machen“, postuliert der Forscher. Diese Hülle aus Elektronen ist dabei mehr als hunderttausend Mal größer als der massive Kern – entsprechend selten kommt es daher vor, dass ein Alphateilchen genau diesen winzigen Kern trifft.
Nadja Podbregar
Stand: 21.06.2013