g-o.de: Was unterscheidet den von ihnen entwickelten Impfstoffkandidaten vom alten BCG?
Kaufmann: Wir haben den klassischen Impfstoff BCG stärker immunogen gemacht. Das heißt, wir haben ihn mit Hilfe molekularbiologischer Methoden so verändert, dass die durch den Impfstoff ausgelöste Immunantwort den Tuberkulose-Erreger besser bekämpfen kann. Obwohl BCG durchaus eine Immunantwort induziert, die ausreicht, die schlimmsten Formen der Tuberkulose bei Kleinkindern zu verhindern, ist diese Immunantwort nicht in der Lage, die häufigste Krankheitsform – nämlich die Lungen-Tuberkulose bei Erwachsenen – einzudämmen. Die Immunität gegen Tuberkulose wird von T-Lymphozyten getragen und zwar von unterschiedlichen T-Zell-Untergruppen. Der neue BCG-Impfstoff ist sowohl qualitativ als auch quantitativ besser, d. h. er stimuliert ein breiteres Spektrum an T-Zellen, die eine stärkere Antwort induzieren.
g-o.de: Wie sind Sie darauf gekommen, gerade bei den Makrophagen anzusetzen? Wie gehen Sie bei der Suche nach Ansatzstellen vor?
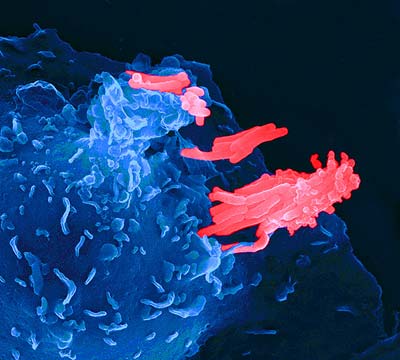
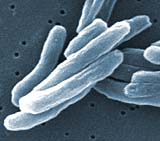
Kaufmann: Der Tuberkulose-Erreger ist ein intrazelluläres Bakterium, d. h. er überlebt in Makrophagen. Damit unterscheidet er sich von den meisten anderen bakteriellen Krankheitserregern, die von aktivierten Makrophagen abgetötet werden. Makrophagen werden durch T-Lymphozyten koordiniert, die die Makrophagen aktivieren sie, also in die Lage versetzen, besser mit den Erregern intrazellulär fertig zu werden.
Makrophagen spielen bei der Tuberkulose eine zweischneidige Rolle. Zum einen sind sie auch gegen Tuberkulose die wichtigsten Effektorzellen. Jedoch gelingt es den aktivierten Makrophagen lediglich die Tuberkulose-Erreger am Wachstum zu hemmen. Damit persistiert der Erreger im Makrophagen. Ja, er nutzt sie regelrecht als bevorzugten Lebensraum. Hinzu kommt noch eine dritte Rolle des Makrophagen sowie eines weiteren Zelltyps – die dendritischen Zellen – bei der Tuberkulose. Makrophagen und dendritische Zellen sind für die antigen-spezifische Stimulation der T-Lymphozyten zuständig.
Unser neuer Impfstoff treibt wahrscheinlich Makrophagen in den Selbstmord. Dies führt dazu, dass die absterbenden Zellen kleine Vesikel (Blässchen) bilden, in denen die Impfantigene stecken. Andere antigenpräsentierende Zellen, nämlich die dendritischen Zellen nehmen nun diese Bläschen auf und können dann besser die T-Zellen mit Spezifität für die Impfantigene stimulieren. Was uns also gelungen ist: Während der Impfstoff BCG für das Immunsystem teilweise nicht erkennbar ist, werden die Antigene des neuen Impfstoffs vom Immunsystem besser erkannt. Dies führt zu einer stärkeren Immunantwort gegen den Erreger.
g-o.de: Wie ordnen Sie diesen Impfstoffkandidaten gegenüber den anderen jetzt in der klinischen Phase befindlichen ein? Wie sehen Sie seine Chancen? Wann gibt es erste Ergebnisse?
Kaufmann: Unser Impfstoff ist als Ersatz für den klassischen BCG-Impfstoff gedacht. Andere Impfstoffe, die derzeit gegen Tuberkulose entwickelt werden, sind Spaltvakzinen, die in präklinischen Untersuchungen keinen besseren Schutz gegen Tuberkulose als BCG hervorrufen. Vielmehr ist dabei vorgesehen, den durch BCG induzierten Impfschutz zu verstärken. Dieses Impfschema wird als heterologes "Prime/Boost-Schema" bezeichnet. Man setzt einen "Prime" mit BCG und kommt später mit einem "Boost" mit einem Impfstoff, der ein oder zwei Antigene enthält. Dagegen stimuliert unser Impfstoff einen Schutz, der in präklinischen Untersuchungen deutlich besser ist als der durch BCG induzierte Schutz. Wir wollen also BCG durch unseren Impfstoff ersetzen.
g-o.de: Wie lange wird es ihrer Einschätzung nach dauern, bis ein umfassend wirksamer Impfstoff gegen die Tuberkulose auf dem Markt ist?
Kaufmann: Die ersten klinischen Studien der Phase I haben für mehrere Tuberkulose-Impfstoffkandidaten begonnen. Dabei wird die Sicherheit und Verträglichkeit des Impfstoffs überprüft. Ein Impfstoff-Kandidat wird bald in eine Phase II klinische Studie treten. In diesen Untersuchungen wird versucht, über die Messung der Immunantwort festzustellen, wie gut das Impfstoffpotential eigentlich ist. Frühestens 2008 geht es dann in die ersten großen Phase III Studien, die feststellen sollen, ob Schutz induziert wird. Danach muss man mit weiteren 10 Jahren rechnen. Unser Impfstoff wird mit aller Wahrscheinlichkeit Anfang 2007 in Phase I treten, so dass wir mit ersten eindeutigen Resultaten ca. 10-12 Jahre später rechnen können.
g-o.de: Wie könnte die Tuberkulose-Impfung der Zukunft aussehen?
Kaufmann: Aus meiner Sicht stellt sich die ideale Tuberkulose-Impfung als ein "Prime/Boost-Schema" mit dem bestmöglichen "Prime-Kandidaten" und dem bestmöglichen "Boost-Kandidaten" dar. Ich bin guter Hoffnung, dass unser Impfstoff der beste Prime-Kandidat sein wird.. In vergleichenden Impfstudien sollte festgestellt werden, welcher Kandidat sich als bester "Boost-Impfstoff" beweist. Dies dauert natürlich einige Zeit. Deshalb müssen wir von Anfang an Biomarker charakterisieren und definieren, die es uns ermöglichen, die Effektivität der einzelnen Impfstoffkandidaten so früh und so genau wie möglich zu bestimmen.
Mit Unterstützung der Bill und Melinda Gates Stiftung versuchen wir mit sieben Partnern in Afrika und mehreren Partnern in Europa und den USA sogenannte Biosignaturen zu definieren, die für Schutz und Schaden bei der Tuberkulose zumindest charakteristisch sind und hoffentlich sogar prädiktiven Wert haben. Unter Biosignaturen verstehen wir eine Gruppe von Biomarkern, die in ihrer Gesamtheit Aussagen über Schutz bzw. Schaden ermöglichen. Die Kenntnis solcher Biosignaturen sollte es uns erlauben, schon während früher Phasen der Impfstudien die Effektivität der getesteten Impfstoffe abzuschätzen. Damit können wir bereits früh Kombinationen aus unterschiedlichen Impfstoffen voraussagen, die dann wiederum in klinischen Phasen als "Prime/Boost-Schema" auf ihre Effektivität getestet werden können.
g-o.de: Welche aktuellen Ansätze in der Impfstoffentwicklung allgemein halten Sie für besonders viel versprechend?
Kaufmann: Alle unsere heutigen Impfstoffe sind das Ergebnis von Arbeiten des letzten Jahrhunderts. Die meisten wurden in den 50er Jahren des 20. Jahrhunderts entwickelt. Dies alles geschah empirisch. Die Empirie hat nun aber mehr oder weniger ihre Grenzen erreicht. Die Impfstoffe, die auf diese Weise entwickelt werden können, wurden gefunden.
Nun müssen wir auf rationale Impfstoff-Entwicklungen bauen und hier können wir in erster Linie auf unsere neuen Kenntnisse in der Immunologie, der Molekularbiologie und der Zellbiologie setzen. Insbesondere unsere neueren Erkenntnisse in der Immunologie haben uns gezeigt, wie wir gezielt die Immunogenität verbessern können. Früher haben wir uns hauptsächlich auf die Identifizierung sogenannter protektiver Antigene fokussiert, also welche Antigene im Impfstoff präsentiert sein müssen.
Heute wissen wir, dass das für die Krankheiten, für die wir noch keine Impfstoffe haben, nicht ausreicht. Neben die Auswahl des protektiven Antigens, muss die Verbesserung der Immunogenität treten, d. h. die Stärke des Schutzes, die ein Impfstoffantigen induziert, muss deutlich verbessert werden. Wir lernen dabei von den Abwehrkräften, die sich bei natürlichen Infektionen entwickeln. Häufig reicht das aber nicht und wir müssen Wege entwickeln, diese natürliche Immunantwort weiter zu verstärken, d. h. wir müssen besser sein als die Natur. Dies ist nun möglich geworden.
Stand: 23.06.2006