Flüssiges Wasser als „Medium des Lebens“ besitzt einzigartige Eigenschaften, wie der Vergleich mit molekular ähnlichen Substanzen zeigt: Bei Normaldruck liegt beispielsweise Ammoniak im Temperaturbereich von 0°C bis 100°C gasförmig vor. Bei genügend tiefen Temperaturen gehen alle Stoffe in den festen Zustand über und ziehen sich dabei zusammen – sie werden dichter als ihre Flüssigkeit. Deshalb geht festes Eisen auch in seiner Schmelze unter. Wasser dagegen expandiert beim Gefrieren. Aufgrund der geringeren Dichte von Eis schwimmen Eisberge auf der Wasseroberfläche.
Auch die Lösungsmitteleigenschaften des Wassers sind untypisch. Es mischt sich nur begrenzt mit vielen organischen Verbindungen. Fette oder Öle bilden im Wasser unmischbare Bereiche oder Filme auf der Oberfläche. Deshalb benötigen wir zur Reinigung überhaupt Waschmittel beziehungsweise Seife. Grund dafür sind die langen Kohlenwasserstoffketten in typischen Fetten, die sich wasserabweisend (hydrophob) verhalten. Hydrophobe Bereiche kommen auch in biologischen Makromolekülen vor. Sie können sich ungünstig auf die Stabilisierung biomolekularer Strukturen auswirken, bei der Wasserstoffbrückenbindungen eine entscheidende Rolle spielen, die so genannte Hydration.
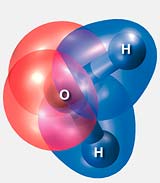
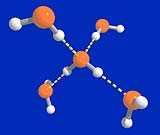
Diese besonderen Eigenschaften ergeben sich aus dem molekularen Aufbau des Wassermoleküls H2O: Es besitzt zwei Wasserstoffatome und am Sauerstoff zwei freie Elektronenpaare. Daraus ergibt sich die Koordination eines zentralen Moleküls mit vier Nachbarmolekülen in tetraedrischer Anordnung. Das Wasserstoffatom in der Wasserstoffbrücke ist eindeutig dem Sauerstoffatom zugeordnet, mit dem es über einen kurzen Abstand verbunden ist. Der Abstand zum zweiten Sauerstoffatom ist wesentlich größer. Das Wassermolekül bleibt in solchen Wasserstoffbrückenbindungen intakt.
Die Bedeutung dieser zwischenmolekularen Wechselwirkungen für die Stoffeigenschaften ist mit einfachen Theorien der Flüssigkeitsphysik nicht zu klären. Erst Computersimulationen haben in den letzten Jahren entscheidend zu einem Verständnis der Eigenschaften von Wasser und einfachen wässrigen Lösungen über weite Temperatur- und Druckbereiche beigetragen. So haben simulierte Flüssigkeitsstrukturen wenig mit Festkörperstrukturen des Eises gemeinsam. Flüssiges Wasser ist eher ein zufälliges, rasch fluktuierendes Netzwerk aus dreidimensional angeordneten Wasserstoffbrückenbindungen.
Stand: 07.01.2005