Auf dem Verständnis der Eigenschaften von Wasser und wässrigen Lösungen einfacher organischer und anorganischer Stoffe aufbauend, richten die Forscher ihr Interesse nun verstärkt auf die Rolle des Wassers bei biomolekularen Prozessen. Biologisch relevante Makromoleküle besitzen eine komplexe Struktur mit hydrophoben und hydrophilen Bereichen. So bestimmen die lokalen Wasserstrukturen an Proteinoberflächen deren Funktion wesentlich mit, sind aber bisher noch weitestgehend unerforscht.
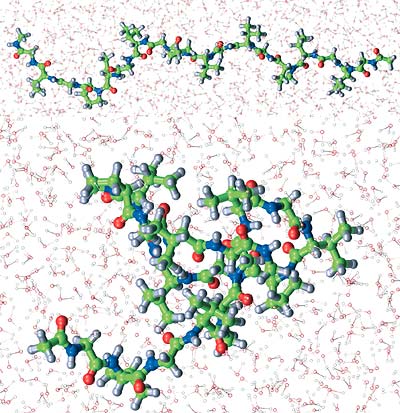
Die Wasserschichten, von denen die Makromoleküle und Membranen im Zytoplasma einer Zelle umgeben sind, reichen nur über wenige Moleküllagen. Es ist fraglich, ob die Eigenschaften von Wasser in diesen eingeschränkten Geometrien mit denen des reinen, flüssigen Wassers überhaupt vergleichbar sind. Untersuchungen der Struktur und Dynamik von Wasser an molekularen Grenzflächen sind Gegenstand der im Jahr 2001 ins Leben gerufenen „Forschergruppe Wasser“ der Deutschen Forschungsgemeinschaft an den Universitäten Dortmund und Bochum.
Bei biomolekularen Prozessen nimmt die Faltung beziehungsweise Entfaltung der Proteine eine herausragende Stellung ein. In den für die biologische Aktivität wesentlichen sogenannten nativen Strukturen sind Proteine „gefaltet“. Bei Temperatur- und Druckstress oder einer durch Zusatzstoffe veränderten Lösungsmittelumgebung können sie sich jedoch entfalten, was in der Regel bei Temperaturerhöhung passiert.
Ein alltägliches Beispiel ist das Hartwerden der Eier beim Kochen (Denaturierung). Die Begründung dafür gibt die Thermodynamik des Prozesses selbst: Hohe Temperaturen begünstigen den Übergang zu „ungeordneteren Phasen“ – ein Maß dafür ist die so genannte Entropie – in denen die Proteine meist entfaltet und damit weniger aktiv sind.

Ein Oligopeptid – ein niedermolekulares Modell für ein Bindegewebsprotein aus der Elastinfamilie – zeigt jedoch das umgekehrte Verhalten: Es faltet sich bei Temperaturerhöhung im Bereich von ca. 30 – 50°C. Diese „inverse“ Umwandlung könnte als Modell für die Umsetzung von Wärmeenergie in Bewegungsenergie in biomolekularen Maschinen von großem Interesse sein.
Bei näherer theoretischer Analyse dieses Phänomens wird klar, dass die umgebenden Wassermoleküle entscheidend dazu beitragen, dass sich die gefaltete Konformation stabilisiert. Wir untersuchen derzeit die Rolle des Wassers bei diesem Prozess experimentell sowie durch umfassende molekulardynamische Simulationen.
Erste Ergebnisse sprechen dafür, dass sich das dynamische Verhalten der an das Protein gebundenen Wassermoleküle bei der Faltung abrupt ändert. Für die Stabilität und Funktion von biologischen Strukturen scheint damit nicht nur die Struktur, sondern auch die Dynamik des Wassers an der Proteinoberfläche von essenzieller Bedeutung zu sein.
Stand: 07.01.2005






