Erste Kandidatenfür die Rolle der Botenstoffe sind bereits identifiziert. Den Stand des Wissens hat Tanaka vergangenes Jahr selbst in einem Artikel für die Fachzeitschrift Cell beschrieben. „Wir wissen, dass die Blutgerinnung den Startschuss für die Regeneration gibt“, erklärt sie. Wenn Blut mit verletztem Gewebe in Kontakt kommt, werden Enzyme aktiviert, die im Serum gelöste Proteine spalten, sodass diese klebrig werden und zu einem Pfropf gerinnen. Diese Gerinnsel setzen offenbar gleichzeitig ein Hormon frei, das den im gesunden Gewebe sitzenden Zellen signalisiert, dass es in der Nachbarschaft etwas zu reparieren gibt, und das diese Zellen gleichzeitig an den Ort der Verletzung lockt.
Noch rätseln die Forscher über die Natur des Stoffs. Aber Tanaka weiß, dass es eine zumindest sehr ähnliche Substanz auch im Blut von anderen Tierarten gibt, etwa bei jungen Horntieren wie Kälbern. „Wir haben dieses Molekül eingegrenzt und hoffen, es in den nächsten Monaten identifizieren zu können“, sagt Tanaka. Spannend wird sein, ob beim Menschen ein ähnliches Hormon existiert und welche Wirkung es gegebenenfalls hat. Die Forscher wissen bereits, dass Muskel- und bestimmte Nervenzellen Rezeptoren für das Wundsignal besitzen müssen.
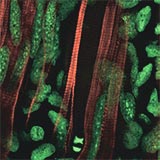
Färbung enthüllt Dedifferenzierung
Bereits vor einigen Jahren konnte Elly Tanaka zusammen mit ihren Mitarbeitern Karen Echeverri und Jonathan Clarke mitverfolgen, wie sich Muskelzellen nach einer Verletzung verhalten. Der Trick: Die Gruppe hatte einen Weg gefunden, einzelnen, noch intakten Muskelfasern einen knallroten Farbstoff zu injizieren, der ihr Verhalten nicht beeinflusst. Dann haben die Forscher junge, zwei bis drei Zentimeter lange Tiere betäubt und ihnen dann schmerzfrei ein Stück des Schwanzes abgeschnitten. Im intakten Muskel sind normalerweise mehrere Einzelzellen zu einer Riesenzelle, einer Muskelfaser, miteinander verschmolzen.
Dank der Färbung konnte die Gruppe beobachten, dass sich eine einzelne verletzte Muskelfaser zuerst zusammenzieht. Wenn die Faser überlebt, löst sich der Verbund innerhalb von fünf Tagen auf – und die Riesenzelle zer fällt wieder in etwa ein Dutzend Einzelzellen; die Muskelzellen gehen gleichsam ein Stück ihres Entwicklungsweges zurück. „Dedifferenzierung“ nennen Wissenschaftler diesen Prozess.
Zellkarawane zum Schnitt
Und die verjüngten Muskelzellen beginnen anschließend in einer Karawane zur Schnittkante zu wandern, wo sie zusammen mit anderen Zellen das Blastem im Spalt zwischen verletzem Muskel und Deckhäutchen anwachsen lassen. Dort treffen sie auch auf Vorläufer von Nervenzellen. Diese Zellen entstehen anders als Muskelzellen nicht durch Rückentwicklung von reifen Nervenzellen, sondern rekrutieren sich aus unreifen „Vorläufer“-Zellen, die eingestreut im Rückenmark der Tiere sozusagen ständig in Bereitschaft liegen.
Wenn die Zellen in das Blastem eingewandert sind, müssen sie sich orientieren und untereinander die Aufgaben verteilen. Wo soll Muskel hin, wo soll Nervengewebe entstehen? „Offenbar fällt diese Entscheidung in mehreren Schritten“, vermutet Tanaka. Der erste Schritt scheint zu sein, dass die Muskelabkömmlinge durch kleine Tentakel wieder Kontakt zu ihren Nachbarn aufnehmen.
Eine Zeitlang haben die Zellen sogar die Fähigkeit, sich auch in ganz andere Zelltypen umzuwandeln. Vor zwei Jahren fanden Tanaka und Echeverri beispielsweise heraus, dass auch die Zellen aus dem Nervensystem sich zu Muskeln und Knorpel umwandeln konnten. Allerdings scheinen solche Rollenwechsel während der Regeneration nur selten vorzukommen: „Offenbar behalten die meisten Zellen eine Erinnerung an ihre Abstammung und nur einige nutzen ihre Plastizität“, sagt Elly Tanaka.
Stand: 10.09.2004




