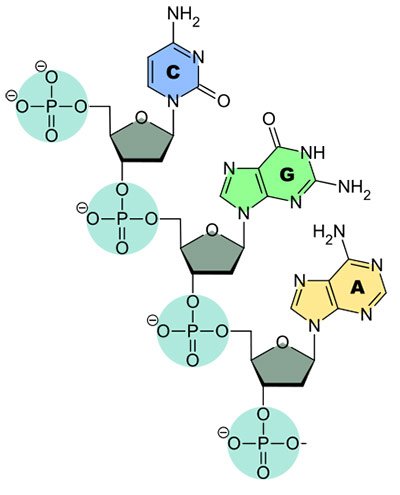
Der erste Schritt hin zu einem DNA-Impfstoff gegen das RS-Virus war es, das für das Oberflächenprotein RSV-F zuständige Gen ausfindig zu machen und zu isolieren. Als die Bochumer Forscher die Bildung des Proteins näher untersuchten, stellten sie Überraschendes fest: Die DNA-Sequenz, die das Virenprotein kodierte, schien nur wenig effektiv abgelesen zu werden. Isolierten die Forscher die DNA-Sequenz für das RSV-F-Protein und brachten sie dieses in eine Zellkultur ein, wurde nur wenig Virenprotein gebildet. Das lag vor allem an Sequenzen, die zu einem verfrühten Abbruch der Transkription – des Ablesens der genetischen Information – und damit der Umsetzung der Erbinformation in ein Protein führen.
Maßgeschneiderte Sequenz…
In einem Impfstoff wäre so ein Abbruch unerwünscht. Daher optimierten die Forscher nun die gesamte DNA-Sequenz für das Protein. Mit der sogenannten Codon-Optimierung – als Codon bezeichnet man eine Sequenz von drei Nukleotiden, die im genetischen Code eine Aminosäure kodiert – und Herstellung dieser Sequenz wurde die Firma GeneArt beauftragt. Bei dieser Optimierung werden die in einem Organismus statistisch am häufigsten verwendeten Codons, die für eine Aminosäure kodieren, als Nukleinsäuresequenz zuerst im Computer und schließlich synthetisch aneinandergefügt. Dadurch entsteht quasi eine maßgeschneiderte und auf maximale Ablesbarkeit optimierte Bauanleitung. Im Fall des RSV-F wurde die Codon-Optimierung so angepasst, dass sie im Organismus Mensch optimal funktioniert.

…erzeugt mehr Proteine
Die optimierte Sequenz testeten die Bochumer Forscher nun erneut in einer Zellkultur mit menschlichen Zellen. Im Vergleich mit der ursprünglichen viralen Sequenz erfolgte dabei eine ungewöhnlich hohe Expression des RSV-F-Proteins. In vergleichenden Analysen konnten sie beobachten, dass die optimierte Sequenz mehr als 5.000-fach mehr Protein produzierte als die ursprüngliche, aus dem Virus isolierte Sequenz.
Dieser ungewöhnlich starke Unterschied ermutigte das Forscherteam, diese Sequenzen als DNA-Impfstoff im Tiermodell weiter zu testen. Auch hier zeigte sich eine klare Überlegenheit der synthetischen DNA-Sequenz. Am eindrucksvollsten war der Effekt zu sehen, nachdem die Tiere mit RSV infiziert wurden. Zum Zeitpunkt der höchsten Viruslast konnten die Tiere, die vorher die synthetische DNA zweimal geimpft bekommen haben, das Virus mehr als zehnfach besser kontrollieren. Ihre Reaktion auf die Infektion verlief deutlich milder und die Viren breiteten sich weniger stark aus.
RUBIN Sonderheft Transfer, Dr. Thomas Grunwald, Ruhr-Universität Bochum
Stand: 05.10.2012