Die von Mendelejew identifizierte Ordnung der Elemente hat mit der Entdeckung der Edelgase ihre erste Feuertaufe mit Bravour bestanden. Und auch die spätere Entdeckung des Yttriums und anderer seltenen Erden können das Periodensystem nicht mehr erschüttern. Ganz im Gegenteil: Die Gesetzmäßigkeiten, die der russische Chemiker vor mehr als 140 Jahren entdeckte, bleiben bis heute gültig.
Neues Wissen stärkt alte Ordnung
Während in der Physik oder Biologie seither ganze Weltbilder durch neue Erkenntnisse weggebrochen sind, hat sich das Periodensystem, Mendelejews „fundamentale Ordnung der Elemente“, tatsächlich als universell erwiesen. Stattdessen haben inzwischen zahlreiche bahnbrechende Entdeckungen der Chemie – vom Bindungsverhalten der Elemente bis zur Struktur der Atomhülle – die Richtigkeit seines Systems bestätigt.
Ausgehend von der Idee der Valenzen, enthüllte beispielsweise Nils Bohr im Jahr 1913, dass die Verteilung der Elektronen in der Atomhülle die Grundlage des Bindungsverhaltens der Elemente bildet. Sein Fund lieferte gleichzeitig die physikalisch-chemische Bestätigung von Mendelejews Elementgruppen: Jede Gruppe im Periodensystem trägt eine andere Anzahl von Elektronen in den Außenschalen der Atome. Sie sind es, die einen Großteil der Elementeigenschaften entscheidend beeinflussen und die es Mendelejew letztlich ermöglichten, so zielgenau die spezifischen Merkmale noch unentdeckter Elemente zu prognostizieren.
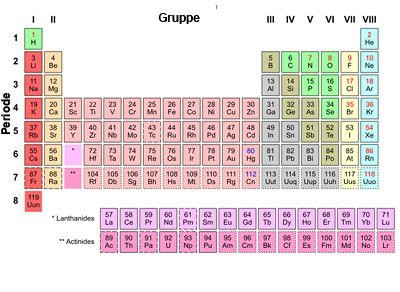
„Leitstern“ für die Elementsuche
Mendelejews Prinzip der „Prognose“ nutzen seine Nachfolger bis heute: „Mendelejews Periodengesetz ist der Leitstern“, erklärt Sergei Aldoshin, Vizepräsident der Russischen Akademie der Wissenschaften. „Als in den 1940er Jahren das erste künstliche Element erzeugt wurde, war die große Frage, wie man es identifizieren und seine Eigenschaften beschreiben sollte.“ Denn nach den Regeln der „International Union of Pure and Applied Chemistry“ (IUPAC) wird ein neu entdecktes oder erzeugtes Element heute erst dann offiziell anerkannt und benannt, wenn auch seine Eigenschaften beschrieben werden können. Dies aber ist beispielsweise bei den extrem instabilen und schnell zerfallenden Transuranen kaum möglich.
Einen Ausweg bietet auch hier das Periodensystem, wie Aldoshin erklärt: „Es hat sich als recht einfach erwiesen, aus der Periodizität auf die Eigenschaften eines Elements zu schließen.“ Inzwischen kennen wir 118 Elemente. Ihre teilweise exotischen Eigenschaften bewegen sich bereits weit jenseits des Vorstellungshorizonts von Mendelejew und seinen Zeitgenossen. Und immer noch werden es mehr, erzeugt unter extremsten Bedingungen in gewaltigen Teilchenschleudern. Wo die Obergrenze liegt und wie viele Elemente es noch werden könnten, weiß niemand so genau…
Nadja Podbregar
Stand: 18.02.2011