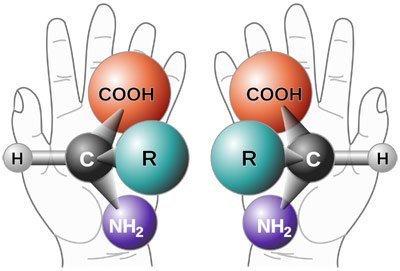
Besonders deutlich wird die Vielseitigkeit der Proteine, wenn man sich den Einfallsreichtum der Evolution anschaut: Einige Entwicklungen der Natur erscheinen wahrhaft exotisch. Das beginnt bereits bei den verwendeten Ausgangsmaterialien. Aminosäuren verhalten sich wie rechte und linke Hand – sie können in zwei Formen existieren, die einander wie Spiegelbilder gleichen, sich räumlich aber nicht decken.
Aus bislang ungeklärten Gründen hat sich bei der Entstehung des Lebens die „linke Hand“-Form durchgesetzt, die L-Aminosäuren. In allen Lebewesen kommt fast ausschließlich diese Form vor. Dem gegenüber stehen die D-Aminosäuren. Diese sind in lebenden Organismen zwar sehr selten, aber bei weitem nicht unbekannt: Neueren Erkenntnissen zufolge dient beispielsweise das D-Serin als Botenstoff im menschlichen Gehirn.
Spiegel-Aminosäuren passen nicht ins Bild
Besonders einige Mikroorganismen haben Tricks entwickelt, mit denen sie die Spiegel-Aminosäuren verwenden können. Doch zu welchem Zweck? Ein Grund ist Schutz: In die Bindungsstellen „normaler“ Enzyme passen diese Spiegelbilder meistens nicht. Feinde oder Konkurrenten haben es deshalb schwerer, sich an diese exotischen Bestandteile anzupassen. Die Zellwand von Bakterien enthält die D-Form der Glutaminsäure, und wird dadurch schwerer durch Verdauungsenzyme angreifbar.
Das gleiche Prinzip funktioniert auch bei einigen Antibiotika: Vancomycin galt lange als Notfall-Antibiotikum gegen hochresistente Bakterien. Es besteht aus sieben Aminosäuren, von denen gleich vier in der D-Form vorliegen. Das erschwert es den Erregern, dagegen Abwehr-Mechanismen zu entwickeln. Zwar sind inzwischen doch bereits einige Resistenzen gegen das Mittel bei mehreren Krankheitserregern aufgetreten, dennoch dienen D-Aminosäuren auch heute noch als wichtiger Bestandteil neuer synthetischer Antibiotika.
Lichtblicke gibt es nicht nur durch spiegelverkehrte Proteinbausteine, ganz normale Proteine lassen in der Natur sogar im wortwörtlichen Sinne ein Licht aufgehen: Die Luciferasen stammen aus verschiedenen Arten von Leuchtkäfern. Mit deren Hilfe bringen die Käfer in Kammern in ihrem Hinterleib ein Substrat namens Luciferin auf chemischem Weg zum Leuchten. Glühwürmchen sind die bekanntesten Anwender dieses Mechanismus. Ähnliche Enzyme lassen auch verschiedene Algen, Bakterien und Pilze leuchten.

Quallenprotein leuchtet für Molekularbiologen
Und schließlich ganz ohne Enzym beginnt eines der bedeutendsten Proteine der molekularbiologischen Forschung zu leuchten: für die Entdeckung des treffend benannten grün-fluoreszierenden Proteins (GFP) erhielten Martin Chalfie, Osamu Shimomura, and Roger Y. Tsien im Jahr 2008 sogar den Nobelpreis für Chemie. Dieses tonnenförmige Protein aus 238 Aminosäuren stammt aus einer Qualle, und tut genau was sein Name sagt. Wenn man es mit ultraviolettem Licht einer bestimmten Wellenlänge anregt, fluoresziert es grün.
Was zunächst simpel klingt, ist für Molekularbiologen ein bedeutendes Werkzeug. Da es sich um ein Protein handelt, lässt es sich durch Genmanipulation in andere Organismen einschleusen. Lebende Zellen sind ebenfalls leicht von abgestorbenen zu unterscheiden. Und da mittlerweile noch mehrere weitere fluoreszierende Proteine anderer Farben bekannt sind, ist es auch möglich, verschiedene Zellen, etwa von unterschiedlichen Bakterienarten, nebeneinander zu markieren.
Bei frühen Experimenten zu derartiger Manipulation war es leicht, mit GFP den Erfolg zu testen: Leuchteten die Zellen, so war das Gen für das Protein in der Tat in der Zielzelle aktiv. Zuerst in solchen Experimenten entstanden Labortiere wie Kaninchen und Mäuse, die unter UV-Licht grün aufleuchten. Daraus entstanden in den USA sogar Haustiere: der „GloFish“, ein kleiner fluoreszierender Aquarienfisch, leuchtet hellgrün durch die eingeschleusten Proteine.
Ansgar Kretschmer
Stand: 21.03.2014