Der „Big Bang der Biologie“, wie die britische Zeitschrift „Economist“ die Erkenntnisse im Forschungsfeld der Epigenetik nannte, beginnt zunächst mit einem Flop – noch dazu bei einem Experiment mit Petunien, biederen Balkonpflanzen, bei denen man nicht gerade innovative Forschungsergebnisse erwartet. Im Jahr 1987 wollen die Biologen Joseph Mol aus den Niederlanden und Richard Jorgensen aus den USA Petunien dazu bringen, intensiver zu blühen. Als Methode entscheiden sie sich für die Gentechnik, die gerade ihren Siegeszug beginnt.
Überraschung vom Balkon
Die Biologen schmuggeln zusätzliche Kopien eines blütenfärbenden Petunien-Gens in die Pflanzen, denn bei der künstlichen Zugabe von Farb-Genen, so ihre Annahme, müsste sich der Farbeffekt vervielfachen. Doch zur Überraschung der Wissenschaftler sind die manipulierten, genetisch veränderten Petunien sogar weniger intensiv gefärbt als die Ausgangspflanzen – und manche sogar völlig farblos. Die Forscher nennen diesen Effekt zunächst Co-Suppression: Offenbar werden die ursprünglichen Gene, die die Färbung zu verantworten haben, gemeinsam mit den hineingeschmuggelten Kopien durch die Manipulation unterdrückt.
Anfang der 1990er Jahre dann stoßen die britischen Pflanzengenetiker David Baulcombe und Andrew Hamilton auf einen ähnlichen Effekt. Sie wollen Kartoffelpflanzen gentechnisch so verändern, dass sie gegen bestimmte Viruserkrankungen resistent werden. Sie schleusen ein einzelnes Virus-Gen in die Pflanzen-DNA ein und hoffen, dass dieses die Pflanzenabwehr mobilisiert und damit eine Resistenz gegen das „Mutter-Virus“ des eingeschmuggelten Gens auslöst. Tatsächlich werden die so behandelten Kartoffelpflanzen nicht krank. Die Forscher sind zufrieden. Doch dann schauen sie nach, was das einzelne Virus-Gen in der Kartoffel tatsächlich macht. Die Überraschung: Es wurde korrekt eingebaut, dennoch ist das Virus-Gen aus irgendeinem Grund stumm und wird nicht abgelesen.
C. elegans und die RNA-Interferenz
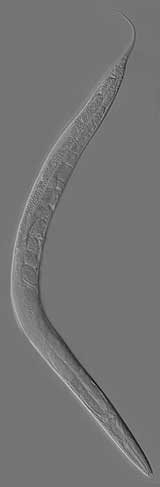
Zur gleichen Zeit wie Baulcombe und Hamilton forschen zwei Teams um Craig Mello von der Massachusetts University und Andrew Fire vom Carnegie Institute in Baltimore am Fadenwurm Caenorhabditis elegans – einem unscheinbaren Tierchen, nur ein bis zwei Millimeter lang und durchsichtig, dafür aber ein Modellorganismus der Molekularbiologie.
Auch diese beiden Forscher bringen, ohne es zu wollen, eigentlich funktionsfähige Gene zum Verstummen. In ihrem Versuch injizieren sie den Würmern zunächst Boten-RNA (mRNA), die ein bestimmtes Muskelprotein kodieren soll. Doch die Würmer reagieren darauf nicht. Es geschieht auch nichts, als die Forscher das komplementäre Gegenstück zu dieser einsträngigen RNA injizieren, die sogenannte „antisense“-RNA – in der Hoffnung, so die rätselhafte Blockade beseitigen zu können.
Eine Reaktion erhalten die Wissenschaftler aber erst, als sie „sense“ und „antisense“-RNA zu einem kompletten Doppelstrang zusammenfügen und den Tieren einimpfen: Sie beobachten seltsame zuckende Bewegungen beim Wurm – ähnlich wie sie auftreten, wenn einem Wurm das Gen für das entsprechende Muskelprotein komplett fehlt. Die Wissenschaftler schlussfolgern, dass die zusätzlich hineingeschmuggelte RNA den Informationsfluss von der DNA zum Protein unterbricht – aber wie?
Um herauszufinden, ob tatsächlich die zweisträngige RNA für das Stummschalten des Gens verantwortlich ist, testen Fire und Mello dies noch mit zahlreichen anderen Genen, die andere Proteine kodieren. Und tatsächlich: In jedem Fall blockieren die RNA-Stücke das Gen mit dem entsprechenden Proteinkode. Das Protein wird nicht mehr gebildet.
RNA: Vom Botendienst zum Forschungs-Star
1998 veröffentlichten Mello und Fire im Wissenschaftsmagazin „Nature“ ihre Ergebnisse – die ihnen im Jahr 2006 den Nobelpreis für Medizin und Physiologie einbringen. Den Mechanismus, den sie entdeckt hatten, nennen sie RNA-Interferenz. Die RNA, Ribonucleic acid, zu deutsch Ribonukleinsäure, ist der „kleine Bruder“ der DNA, der Desoxyribonukleinsäure, die das Erbgut jedes Organismus enthält.
Bis zur Entdeckung von Mello und Fire war diese RNA nur als Transporthilfe bei der Übertragung der genetischen Informationen vom DNA-Molekül zu den Proteinfabriken, den Ribosomen, bekannt. Aber offensichtlich kann die RNA noch viel mehr als bis dato angenommen. Sie ist in der Lage, die Wirkung bestimmter Gene zu unterdrücken, sie quasi stumm zu schalten.
Stand: 26.02.2013