Chemische Grundeigenschaft neu definiert: Forscher haben eine neue Skala der Elektronegativität entwickelt – des Merkmals, das das Bindungsverhalten der chemischen Elemente bestimmt. Die neue Skala basiert auf der Energie der Valenzelektronen und ergibt für einige Elemente, darunter Sauerstoff, Fluor und Kupfer, leicht veränderte Werte. Die zugrundeliegenden Gleichungen könnten Chemie und Materialwissenschaften weiter voranbringen, so die Forscher.
Sie bildet die Grundlage der chemischen Bindung und ist ein wichtiger Indikator für das Verhalten eines Elements: die Elektronegativität. An ihr lässt sich ablesen, wie stark ein Atom in einem Molekül Bindungselektronen an sich zieht – und damit auch, ob beispielsweise bei einer chemischen Reaktion ein Salz entsteht oder ein Molekül mit kovalenten Bindungen. Tendenziell nimmt im Periodensystem der Elemente die Elektronegativität innerhalb einer Periode zu und pro Elementgruppe von oben nach unten ab.
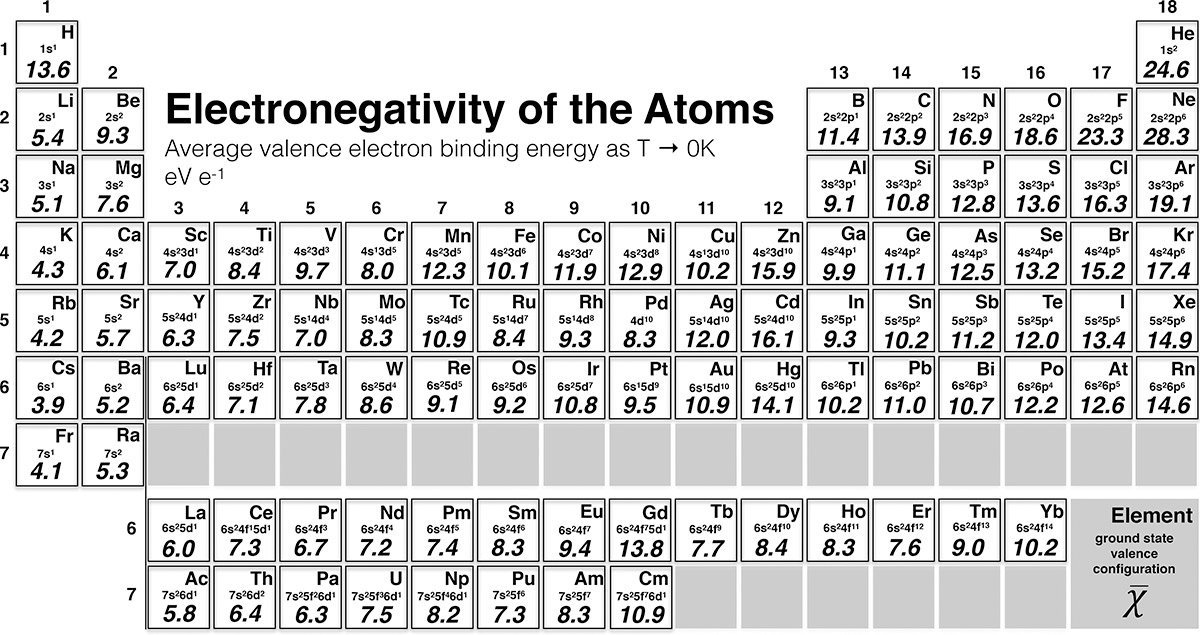
Das Problem jedoch: Bisher existiert keine Skala der Elektronegativität, die alle Elemente des Periodensystems umfasst. Stattdessen gibt es mehrere Skalen, die jeweils auf unterschiedlichen Parametern beruhen. So ermitteln einige Skalen den Wert über die Kernladung und den Atomradius, andere nutzen die Ionisierungsenergie und Elektronenaffinität oder den Energiezustand der Außenelektronen eines Atoms.
Energie der Valenzelektronen als Basis
Jetzt haben Martin Rahm von der Technischen Universität Chalmers in Göteborg und sein Team eine neue Methode vorgeschlagen, um die Elektronegativität eines Elements zu definieren. „Die neue Definition beruht auf der Bindungsenergie der äußeren, am schwächsten gebundenen Elektronen – der Valenzelektronen“, erklärt Rahm. Die Skala ähnele darin der bereits bekannten Allen-Skala, differiere aber in Methodik und Umfang.
Ihre Werte erhielten die Forscher, indem sie experimentelle Daten zur Energie der Valenzelektronen im Grundzustand heranzogen und diese mit quantenmechanischen Berechnungen kombinierten. Auf diese Weise gelang es ihnen, die Elektronegativität für die ersten 96 Elemente des Periodensystems zu ermitteln. Für einige Atome wurde damit erstmals dieser Wert ermittelt.
Sauerstoff und Fluor rutschen ab, Metalle rücken auf
Was aber ändert sich dadurch? „Die meisten Elemente bleiben in ihrer relativen Beziehung zueinander ähnlich wie in den früheren Skalen“, berichtet Rahm. „Aber es gibt auch einige interessante Änderungen, durch die einige Atome ihre Plätze in der Rangfolge der Elektronegativität getauscht haben.“ So haben Sauerstoff und Chrom eine nun leicht geringere Elektronegativität und sind dadurch leicht abgerutscht. Auch das elektronegativste Element Fluor hat etwas geringere Werte als vorher.
Dafür ist die Elektronegativität von Mangan, Kobalt, Nickel, Zinn, Cadmium, Quecksilber, Technetium und Gadolinium in der neuen Skala etwas höher als vorher. Auch die Elementgruppe, zu der die Edelmetalle Kupfer, Silber und Gold gehören, hat nun leicht höhere Werte, wie die Forscher berichten.
Weitreichendes Potenzial
„Die neue Skala ist sehr umfassend und ich hoffe, sie wird die Chemie und Materialwissenschaften entsprechend beeinflussen und voranbringen“, sagt Rahm. So liefern die neuen Elektronegativitäts-Werte unter anderem Hinweise auf mögliche neue Legierungen und chemische Verbindungen. „Zudem können mit unserer neuen Skala eine ganze Reihe von komplizierten quantenmechanischen Berechnungen vermieden werden“, so der Forscher.
Ein weiterer Vorteil: Die neue Skala und die ihr zugrundeliegenden Gleichungen können dabei helfen, auch Energieveränderungen bei nicht von der Elektronegativität kontrollierten Reaktionen zu erklären. Bei diesen chemischen Reaktionen ist die Veränderung der Gesamtenergie im Atom ausschlaggebend für das Resultat. Diese Gesamtenergie lasse sich auf Basis der neuen Methode nun besser ermitteln und analysieren, sagen die Wissenschaftler. (Journal of the American Chemical Society, 2019; doi: 10.1021/jacs.8b10246)
Quelle: Chalmers University of Technology















