Alles begann mit einer Qualle: Als der japanische Biochemiker Osamu Shimomura in den 1960er Jahren das Leuchten von Aequorea victoria untersuchte, stieß er auf ein Molekül, das die Welt verändern sollte. Denn als Quelle der Farbenspiele dieser Quallenart identifizierte der Forscher das grün fluoreszierende Protein (GFP). Dieses Protein fluoreszierte unter UV-Licht hellgrün.

Vom Quallenprotein zum Biomarker
Wie Shimomura herausfand, absorbieren sogenannte Chromophore in dem Protein die Strahlung und werden dadurch energetisch angeregt. Unmittelbar danach kehren sie in ihren Grundzustand zurück und emittieren die aufgenommene Energie wieder – diesmal jedoch als grünes sichtbares Licht. Seine Entdeckung stieß in der Wissenschaftsgemeinde auf großes Interesse und veranlasste viele Forscher dazu, sich dem grün leuchtenden Quallenprotein näher zu widmen.
Mitte der 1990er Jahre gelang es den Molekularbiologen Martin Chalfie und Douglas Prasher, das Gen für GFP zu isolieren und zu sequenzieren. Seitdem ist es möglich, mithilfe der Gentechnik künstlich leuchtende Wesen zu erzeugen und das grün fluoreszierende Protein als Biomarker zu benutzen. Dank Roger Tsien standen dafür bald sogar noch weitere Proteine zur Verfügung. Der Chemiker entwickelte auf Basis des GFPs andere Varianten, die in allen Farben des Regenbogens leuchten.
Transgener Leucht-Zoo
Heute sind das grün fluoreszierende Protein und andere Fluoreszenzproteine aus der medizinischen und biochemischen Forschung nicht mehr wegzudenken. Ihr Leuchtsignal kann in lebenden Zellen oder Organismen biologische Prozesse sichtbar machen, die dem Wissenschaftlerauge sonst verborgen bleiben. Veränderungen von lebenden Hirnzellen, das Wachstum von Tumoren, aber auch Transportprozesse auf Zellebene lassen sich mithilfe fluoreszierender Proteine nachvollziehen.

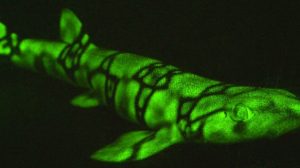
Als Nebeneffekt ist im Laufe der Jahre ein ganzer Zoo transgener Tiere entstanden, die unter bestimmten Bedingungen leuchten – von Fliegen über Fische und Mäuse bis hin zu Affen. Sogar in die Keimzellen von Primaten haben Wissenschaftler das grün fluoreszierende Protein bereits eingeschleust und die Leuchteigenschaft damit an die nächste Generation vererbbar gemacht, ein ethisch nicht unumstrittener Eingriff.
Fische als Wasserkontrolleure
Die meisten fluoreszierenden Lebewesen sind ein Produkt der Medizinforschung. Doch Wissenschaftler haben auch schon zu anderen Zwecken leuchtende Lebewesen erschaffen. Ein Forscherteam der Universität Singapur schleuste das GFP-Gen zum Beispiel in Zebrabärblinge ein, um die Wasserqualität kontrollieren zu können.
Dabei wurde die entsprechende Gensequenz in eine DNA-Region eingebaut, die nur dann aktiv wird, wenn die Fische einen körpereigenen Reinigungsmechanismus brauchen. Halten sich die Tiere in mit bestimmten Schadstoffen verunreinigtem Wasser auf, wird dieser Mechanismus angekurbelt – und die Fische beginnen bei Anwesenheit von Tages- oder Kunstlicht zu leuchten. Später wurden ähnlich veränderte Fische sogar unter dem Markennamen „GloFish“ als Aquariumfische vermarktet. Sie leuchteten allerdings ständig.
Mit dem Nobelpreis geehrt
Klar ist: Ohne das Phänomen der Biofluoreszenz wären viele wissenschaftliche Erkenntnisse und Errungenschaften der vergangenen Jahre nie möglich gewesen. „Fluoreszierende Organismen haben die moderne Forschung nachhaltig verändert“, betont der Chemiker Marc Zimmer vom Connecticut College in New London, der ein Buch über biologische Leuchtphänomene geschrieben hat.
Der großen Bedeutung der fluoreszierenden Proteine als Forschungswerkzeug hat auch das Nobelpreis-Komitee schon Rechnung getragen. 2008 erhielten Osamu Shimomura, Martin Chalfie und Roger Tsien die begehrte Auszeichnung für ihre Beiträge zur Entwicklung jener Markerproteine, die inzwischen für viele Wissenschaftler unverzichtbar geworden sind.