Flexibel und geschützt: Forscher haben neue, unerwartete Einblicke in die Struktur des Spike-Proteins von SARS-CoV-2 gewonnen – dem Protein, mit dem das Coronavirus an unsere Zellen andockt. Demnach besitzt der Stiel dieser „Krönchen“ drei Gelenke, die den Proteinkopf mit der Bindungsstelle ungewöhnlich beweglich machen. Zudem sind Stiel und Teile des Proteinkopfes von einer dickeren Schutzhülle aus Zuckern bedeckt als angenommen – das ist für die Impfstoffentwicklung wichtig.
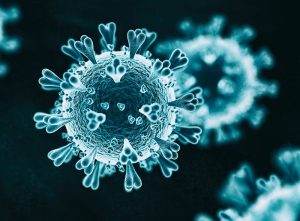
Die stachelartig vorstehenden Spike-Proteine des Coronavirus SARS-CoV-2 sind nicht nur äußerlich sein hervorstechendstes Merkmal – sie spielen auch für die Infektion und Abwehr dieses Virus eine entscheidende Rolle. Denn am knubbeligen Kopf dieses Proteins liegt die Bindungsstelle, mit der das Virus an den ACE2-Rezeptor auf unseren Zellen andockt und in sie eindringt. Gleichzeitig dient diese Struktur unseren Antikörpern als Erkennungsmerkmal bei der Bekämpfung und wird deshalb auch von Impfstoffen genutzt.
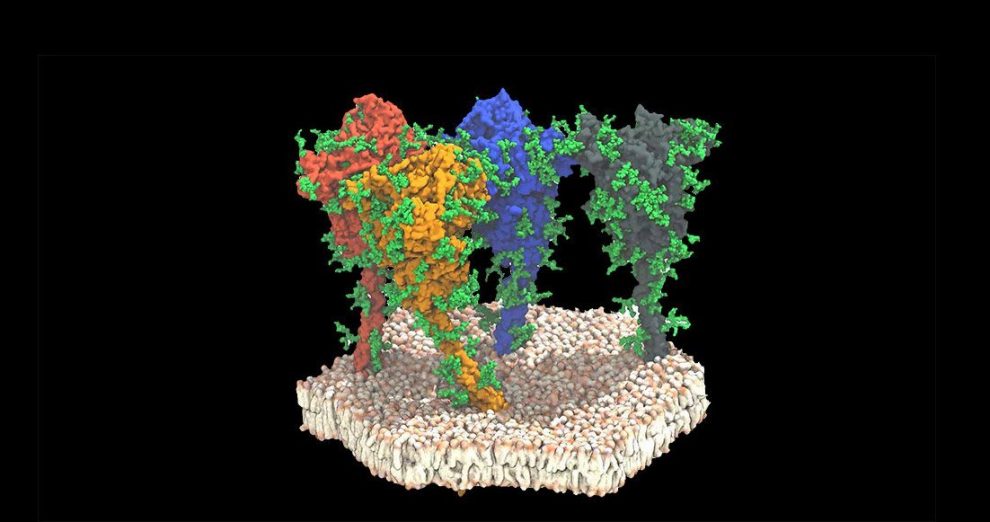
Struktur des Spike-Proteins in situ
Umso wichtiger ist es, die Struktur des Spike-Proteins möglichst genau zu kennen. Zwar gab es schon atomgenaue Strukturmodelle des isolierten Proteins, die genaue Konfiguration dieses Proteins in seiner natürlichen Position war aber bislang nur in Teilen bekannt. Jetzt ist es Forschern um Beata Turonova vom European Molecular Biology Laboratory (EMBL) in Heidelberg erstmals gelungen, die molekulare Struktur des Spike-Proteins an intakten Viren und mit nahezu atomarer Auflösung zu analysieren.
Für ihre Studie nutzten die Forscher zunächst die Kryo-Elektronenmikroskopie, um hochaufgelöste Momentaufnahmen von 1.000 gefriergetrockneten Viren mitsamt ihrer Proteine zu erstellen. Diese Kryotomogramme zeigten bereits einzelne Protein-Untereinheiten der im Schnitt rund 40 Spike-Proteine pro Virus. Eine computergestützte Verarbeitung der Tomogramme erlaubte es dann, Kopf und Stiel der Spike-Proteine fast atomgenau zu kartieren.
Drei „Gelenke“ im Proteinstiel
Das überraschende Ergebnis: Die Stiele des viralen Spike-Proteins sind viel beweglicher als zuvor angenommen. „Es wurde erwartet, dass der Stiel ziemlich starr sein würde,“ sagt Koautor Gerhard Hummer vom Max-Planck-Institut für Biophysik in Frankfurt. „Aber in unseren Modellen und Bildern entdeckten wir, dass die Stängel extrem flexibel sind.“ Dadurch kann sich der Proteinkopf mit der Bindestelle fast im rechten Winkel neigen.
„Wie ein Ballon an einer Schnur scheinen sich die Stängel auf der Oberfläche des Virus zu bewegen und können so nach dem Rezeptor für das Andocken an die Zielzelle suchen“, erklärt Koautorin Jacomine Krijnse Locker vom Paul-Ehrlich-Institut. Ursache für diese Beweglichkeit sind drei Gelenke am Stiel des Spike-Proteins, wie die Forscher entdeckten. Diese Scharniere – Hüfte, Knie und Knöchel – sind zwischen 18 und 28 Grad kippbar und geben dem Kopf so seine große Bewegungsfreiheit.
Dicker Zuckermantel
Die Aufnahmen enthüllten zudem, dass das gesamte Spike-Protein von einer dichten Hülle aus zuckerähnlichen Anlagerungen bedeckt wird. Diese Glykane verdecken Teile der erkennbaren Proteinstrukturen und erschweren es dem Immunsystem so, das Virus zu erkennen. Gleichzeitig behindern sie Antikörper und Abwehrzellen dabei, an entscheidenden Stellen des Oberflächenproteins anzudocken.
Diese Erkenntnis ist wichtig für den Einsatz von Antikörpertherapien, aber auch für die Impfstoffentwicklung. Denn beide setzen an den Stellen des Spike-Proteins an, die das Virus für die Bindung an die Zellen nutzt – und die offenbar in bestimmten Konfigurationen von SARS-CoV-2 besser geschützt sind als vermutet.
Die gute Nachricht jedoch: Die Bindungsstelle des Spike-Proteins sieht auch in situ ziemlich genau so aus wie aus früheren Untersuchungen an isolierten Proteinen bekannt. „Der obere kugelförmige Teil des Spike-Proteins hat eine Struktur, die von rekombinanten Proteinen, die für die Impfstoffentwicklung verwendet werden, gut reproduziert wird,“ erklärt Koautor Martin Beck vom EMBL. (Science, 2020; doi: 10.1126/science.abd5223)
Quelle: EMBL, Paul-Ehrlich-Institut – Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel