Zählfehler bei der Zellteilung: Forscher haben eine möglicherweise universelle Schwachstelle bei Krebszellen entdeckt. Dabei handelt es sich um ein Protein, das eine wichtige Rolle für die Chromosomentrennung bei der Zellteilung spielt. Offenbar benötigen die Tumorzellen es, um trotz überzähliger Chromosomen zu überleben. Seine Blockade könnte daher einen Ansatzpunkt für neue Therapien bilden, wie die Forscher im Fachmagazin „Nature“ berichten.
Krebs entsteht, wenn Zellen entarten und sich unkontrolliert vermehren. Je nach Krebstyp und befallenem Gewebe können die genetischen Merkmale solcher Krebszellen aber sehr verschieden sein: Einige entstehen durch gehäufte Fehler bei der DNA-Reparatur, andere durch explosionsartige Schädigung der Chromosomen. Diese individuellen Unterschiede machen es so schwer, Tumorleiden effektiv zu bekämpfen.
Mehr Chromosomen als normal
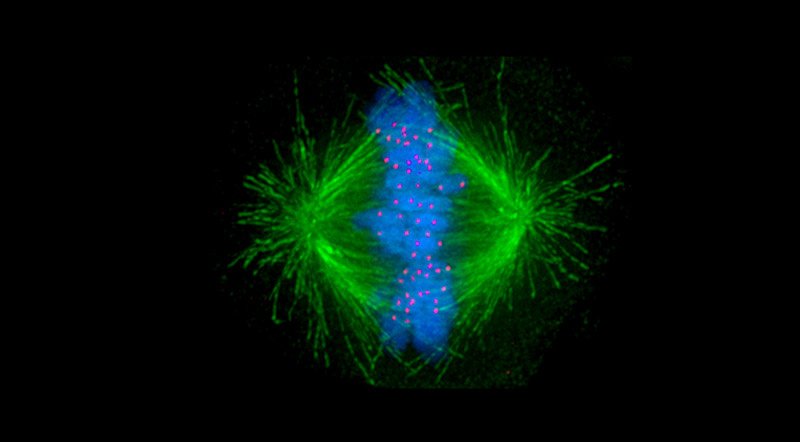
Doch es gibt ein Merkmal, das mehr als 90 Prozent aller Krebsarten teilen: Ihre Zellen enthalten mehr als die für unsere Körperzellen normalen 46 Chromosomen. In vielen Tumoren finden sich stattdessen 60 bis 90 Chromosomen pro Zelle, einige Riesen-Krebszellen können sogar den acht- bis 16-fachen Chromosomensatz in sich tragen. Diese als Aneuploidie bezeichneten Anomalien entstehen, weil der Spindelapparat bei der Zellteilung die kopierten Chromosomen nicht säuberlich voneinander trennt.
Jetzt haben Forscher um Yael Cohen-Sharir von der Universität Tel-Aviv ein Protein entdeckt, das für diese Fehlteilungen eine entscheidende Rolle spielt. Aufgespürt haben sie diesen Akteur bei Zellteilungs-Experimenten mit knapp 1.000 Zelllinien von menschlichen Krebspatienten und im Labor gezüchteten Modellkrebszellen. Sie analysierten, welche spezifischen Gene und Moleküle dabei in den aneuploiden Zellen aktiv sind.
Protein-Blockade lässt Krebszellen sterben
Das Ergebnis: Bei den Krebszellen ist ein bestimmter Schritt in der Zellteilung verändert. Dieser sogenannte mitotische Checkpoint kontrolliert normalerweise, ob der Spindelapparat die Schwesterchromosomen korrekt getrennt hat und leitet erst dann die Zellteilung ein. Bei den aneuploiden Krebszellen jedoch ist dieser Checkpoint gestört. Während normale Zellen aber bei falscher Chromosomenzahl schnell absterben würden, leben sie weiter.
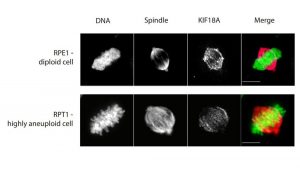
Einer der Gründe dafür könnte das Protein KIF18A sein, wie nun Cohen-Sharir und seine Kollegen herausgefunden haben. KIF18A ist ein Kinesin-Motorprotein – ein Molekül, das an die mitotische Spindel bindet und so zur Kontrolle der Chromosomentrennung beiträgt. Wird die Produktion dieses Proteins bei Krebszellen blockiert, verlieren sie die Fähigkeit, trotz der überzähligen Chromosomen langfristig zu überleben.
Die Forscher wissen noch nicht genau, was KIF18A in aneuploiden Zellen anders macht als in normalen Zellen, aber sie vermuten, dass es der sich teilenden Zelle irgendwie hilft, die abnorm hohe Anzahl von Chromosomen physikalisch unterzubringen. Mittels Bildgebung konnte sie feststellen, dass die mitotische Spindel in den aneuploiden Zellen eine andere Form hat als in normalen Zellen.
Ansatzstelle für breiter wirksame Krebstherapien
Nach Ansicht der Wissenschaftler könnte das KIF18A-Protein einen neuen Ansatzpunkt für die Tumorbekämpfung bieten: „Im Moment gibt es zwar noch keine Inhibitoren, die KIF18A in menschlichen Zellen blockieren. Wenn wir jedoch den Mechanismus besser verstehen, könnten wir chemische Moleküle entwickeln, die KIF18A selbst oder die damit verbundenen Prozesse angreifen“, erklärt Koautorin Zuzana Storchová von der Technischen Universität Kaiserslautern.
Allerdings muss zuvor noch geklärt werden, ob die jetzt beobachteten Mechanismen auch in Tumoren im menschlichen Körper so ablaufen. „Unsere Ergebnisse basieren alle auf Zellkulturen und deshalb wissen wir noch nicht, wie gut sie sich auf tatsächliche menschliche Patienten übertragen lassen“, sagt Seniorautor Uri Ben-David von der Universität Tel-Aviv. „Dennoch eröffnen sie vielversprechende Forschungsgebiete, die das Potenzial haben, letztlich die Versorgung von Krebspatienten zu beeinflussen.“ (Nature, 2021; doi: 10.1038/s41586-020-03114-6)
Quelle: Technische Universität Kaiserslautern