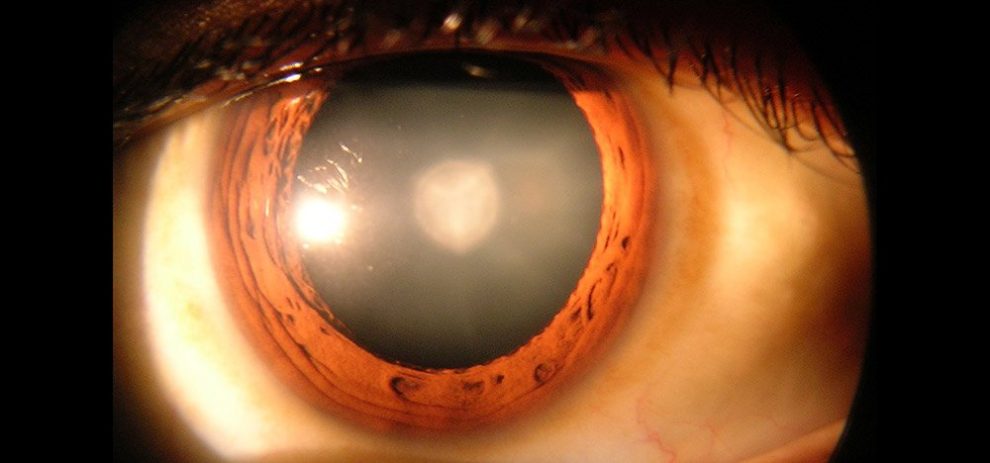
Widerspruch zur Theorie: An der Trübung der Augenlinse beim Grauen Star sind offenbar nicht fehlgebildete Proteine schuld. Stattdessen ist das Gleichgewicht der verschiedenen Linsenproteine bei dieser altersbedingten Erkrankung gestört, wie nun eine Studie nahelegt. Diese Dysbalance führt dann zum vermehrten Verklumpen der Proteine und trübt die normalerweise glasklare Augenlinse nach und nach ein.
Der Graue Star ist die häufigsten Augenerkrankung bei älteren Menschen. Er tritt auf, wenn die hochkonzentrierten, gelösten Proteine der Augenlinse verklumpen und auskristallisieren. Weil die als Alpha-, Beta- und Gamma-Kristalline bezeichneten Linsenproteine schon im Embryo gebildet werden und nicht ersetzt werden, führt dieses Auskristallisieren mit der Zeit zu einer immer stärker werdenden Eintrübung der Linse.
Warum verklumpen die Linsenproteine?
Doch wie und warum es zu diesem Verklumpen der Linsenproteine kommt, ist bislang erst in Teilen bekannt. Gängiger Lehrmeinung nach wirken die Alpha-Kristalline im Auge normalerweise als eine Art Schutztruppe. Sie können fehlgebildete Proteine binden und diese so vor den Verklumpen bewahren. Im Laufe des Lebens sind jedoch immer mehr dieser Schutzproteine „besetzt“ und dadurch können sich Verklumpungen häufen – so die Theorie.
Um herauszufinden, ob das stimmt, haben Philipp Schmid von der Technischen Universität München und seine Kollegen das Verhalten der Linsenproteine näher untersucht. Dafür analysierten sie die Zusammensetzung und Kristallisation der Kristalline im Verlauf des Lebens bei verschiedenen Mäusestämmen mit und ohne Veranlagung zum Grauen Star.
Fehlgebildete Proteine sind nicht die „Täter“
Das überraschende Ergebnis: „Wir haben herausgefunden, dass die mutierten, instabilen Proteine in der Augenlinse gar nicht vorhanden sind“, erklärt Schmids Kollege Johannes Buchner. „Sie werden sofort abgebaut.“ Dadurch blieb die eigentlich erwartete Übersättigung des schützenden Alpha-Kristallins mit diesen fehlgebildeten Proteinen aus.
Dennoch kam es mit dem Altern der Mäuse zu einer Verklumpung von Linsenproteinen und der Linsentrübung. Sie trat sowohl bei den Mäusestämmen mit genbedingt mutierten Linsenproteinen auf als auch bei einem Stamm, der zum altersbedingten Grauen Star neigt. „Die Chaperon-Funktion der Alpha- Kristalline und die Stabilität der mutierten Kristalline sind demnach nicht die entscheidenden Faktoren für die Katarakt-Entstehung“, konstatieren die Forscher.
Protein-Gleichgewicht gestört
Was aber ist dann die Ursache? Einen Hinweis darauf lieferte der Vergleich der Anteile verschiedener Linsenproteine bei den Tieren: Die Mäuse, die Grauen Star entwickelten, hatten einen erhöhten Anteil von Beta- Kristallinen im Vergleich zu den Alpha- Kristallinen. Zudem wurde die dritte Proteinsorte, das Gamma-Kristallin, bei ihnen im Verlauf des Lebens besonders schnell abgebaut. Insgesamt war dadurch das Gleichgewicht der verschiedenen Kristalline gestört.
„Unser aus den neuen Erkenntnissen entwickeltes Modell ist, dass die Balance der verschiedenen Proteine und damit ihr Verhältnis zueinander wichtig ist“, erklärt Buchner. „Wenn eins dieser Bestandteile fehlt, interagiert der Rest und verklumpt.“
Neue Ansätze für die Therapie
Nach Ansicht der Forschenden könnten diese Erkenntnisse neue Ansätze zur Behandlung des Grauen Stars eröffnen. Die gängige Therapie ist bislang eine Operation, bei der die getrübte Linse entfernt und eine künstliche Linse ins Auge eingesetzt wird. „Wenn man versteht, was genau passiert, kann man auch überlegen, wie man die falschen Interaktionen vielleicht mit Medikamenten stören kann“, sagt Buchner.
Tatsächlich haben Tierversuche bereits gezeigt, dass es chemische Wirkstoffe gibt, die die Alpha-Kristalline stabilisieren und die Kataraktbildung im Auge bremsen können. Doch noch sind diese Forschungen im Anfangsstadium. „Das ist allerdings noch ein weiter Weg – und zunächst muss gezeigt werden, dass das vorgeschlagene Modell auch für menschliche Augenlinsen zutrifft“, betont Buchner. (Nature Structural & Molecular Biology, 2021; doi: 10.1038/s41594-020-00543-9)
Quelle: Technische Universität München