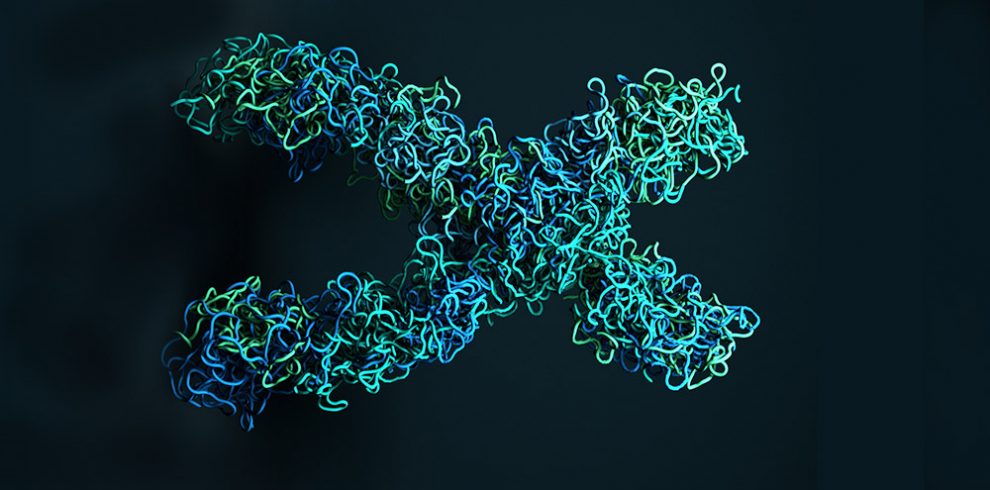
Erbgut aufgeräumt: Unsere fast zwei Meter lange DNA liegt in Schlaufen gefaltet im Zellkern – nur so passt das Erbgut in die Zelle und in die Chromosomen. Wie dieses Einschlaufen funktioniert, haben Forscher nun erstmals direkt beobachtet. Demnach bindet ein Proteinkomplex mit seinem Mittelgelenk und zwei beweglichen Armen abwechselnd an den DNA-Strang und klappt dabei auf und zu. Angetrieben wird dieser molekulare Motor durch das Energiemolekül ATP, wie das Team im Fachmagazin „Cell“ berichtet.
Es ist ein Wunder der Natur: Das Erbgut in jeder unserer Zellen ist aneinandergelegt 1,80 Meter lang, trotzdem passt es in den winzigen Zellkern und wird bei jeder Zellteilung fein säuberlich in Chromosomen verpackt. Bei einigen Pflanzen stecken in jeder Zelle sogar fast 100 Meter an DNA. Wie unsere Zellen diese Verpackung bewerkstelligen, haben Wissenschaftler erst in den letzten Jahren zu enträtseln begonnen.
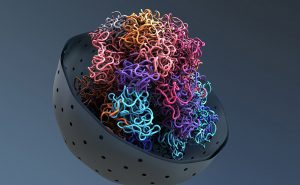
Demnach legen spezielle Proteinkomplexe die DNA-Stränge in Schlaufen oder Zickzack zusammen und formen so mehr oder weniger geordnete, kompakte Gebilde, die dann zum Chromatin der Chromosomen weiterverpackt werden. Die Art und Weise, wie die DNA in Schlaufen liegt, beeinflusst zudem, welche Gene abgelesen werden können und wie verschiedene Bereiche der DNA miteinander interagieren.
Ein Gelenk und zwei klappbare Arme
Doch wie das Schlaufenlegen im Detail funktioniert, war bisher unbekannt. Klar war nur, dass spezielle Proteinkomplexe daran beteiligt sein müssen. Sie bestehen aus zwei Untereinheiten, die über ein Gelenk verbunden sind und entweder parallel nebeneinander liegen oder wie zwei Arme aufgeklappt sein können. An jedem Ende dieser Arme sitzt ein Kopf, der mithilfe des Enzyms ATPase das Energiemolekül ATP binden kann.
Wie dieser ausgeklappt rund 50 Nanometer lange SMC-Proteinkomplex an die DNA bindet – ob nur mit seinen Köpfen oder auch mit dem Mittelgelenk – und wie er dann die Schlaufen erzeugt, haben nun Benedikt Bauer vom Vienna BioCenter und seine Kollegen erstmals direkt beobachtet. Dafür erzeugten sie den SMC-Proteinkomplex Cohesin-NIPBL im Labor und ließen ihn mit DNA-Strängen interagieren. „Cohesin arbeitet wie ein molekularer Motor und nutzt als Treibstoff ATP, um das Genom in Zusammenarbeit mit dem NIPBL-Protein zu falten“, erklärt Bauer.
Vom Strang zur Schlaufe
Die Analysen enthüllten: Der Cohesin-Komplex bindet als erstes mit seinem Mittelgelenk an die DNA und nutzt dafür NIPBL als Bindungshelfer. Dann klappt der Proteinkomplex seine anfangs ausgebreiteten beiden Arme zusammen und bringt so das Gelenk in die Nähe eines seiner beiden ATPase-Köpfe. Mithilfe des NIPBL übergibt dieses die DNA an einen der Köpfe. Das nun freie Mittelgelenk schwingt zurück und kann den DNA-Strang an einer anderen Stellen binden. Dieser Zyklus wiederholt sich immer wieder und legt die DNA dadurch in Schlaufen.
„Stellen Sie sich vor, Sie legen ein Kletterseil zusammen: Einer Ihrer Arme greift dafür ein entferntes Stück des Seils und bringt dieses zum zweiten Arm, der das schon zusammengelegten Seil fest im Griff hält“, sagt Bauer. „Es ist ein einfacher Mechanismus, aber es brauchte Jahre der Laborarbeit, um ihn aufzudecken. Cohesin ist ein sehr kompliziertes Enzym und wir mussten viele Methoden erst neu entwickeln.“
Sicherung gegen Fehler
Interessant auch: Um zu verhindern, dass sich die DNA verheddert oder die Abfolge des Bindens und Klappens durcheinander gerät, hat die Natur eine Art Kontrollinstanz eingebaut: Die Übergabe der gebundenen DNA vom Gelenk an einen ATPase-Kopf funktioniert nur unter Zugabe von ATP. Sobald dieses an den Kopf bindet, löst dies die Streckung der Arme aus und drückt so das Mittelgelenk automatisch wieder vom Kopf weg.
„Weil das NIPBL zu diesem Zeitpunkt die DNA schon am Kopf angedockt hat, muss sich das Gelenk lösen und leer zurückschwingen“, erklären die Forscher. Das stellt sicher, dass das Mittelgelenk die DNA nicht wieder mit sich zurückreißt. „Damit erklärt unser Modelle elegant, wie die DNA-Translokation mit der Kopfbindung und dem ATPase-Zyklus verknüpft ist“, schreibt das Team.
Rückschlüsse auch auf andere SMC-Komplexe
Diese Beobachtungen geben damit erste Einblicke darin, über welche Mechanismen ein SMC-Proteinkomplex die DNA faltet und in Schlaufen legt. Die am Cohesin-NIPBL gewonnenen Einblicke erlauben damit nun auch Rückschlüsse auf die Arbeitsweise anderer, ähnlicher SMC-Proteinkomplexe, wie die Wissenschaftler erklären. Während Cohesin die DNA-Faltung vor allem in der Interphase des Zellzyklus – zwischen den Zellteilungen – übernimmt, leisten andere SMC-Komplexe wie die Condesine diese Arbeit in Vorbereitung der Teilung.
„Die DNA-Faltung ist ein Prozess, der in allen Organismen und allen Stadien des Zellzyklus vorkommt“, sagt Bauers Kollege Jan-Michael Peters. „Die Mechanismen hinter der Funktion des Cohesins aufzudecken ist daher ein Ansatzpunkt, um auch die anderen SMC-Komplexe zu verstehen.“ (Cell, 2021; doi: 10.1016/j.cell.2021.09.016)
Quelle: Research Institute of Molecular Pathology