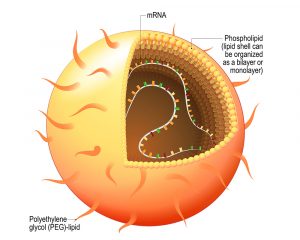
Heute sind die Wissenschaftler von BioNTech, Moderna und anderen auf mRNA spezialisierten Unternehmen gefeierte Pioniere. Ihnen haben wir die effektivsten Impfstoffe gegen das Coronavirus SARS-CoV-2 zu verdanken und damit die Chance, die Corona-Pandemie zu überwinden. Doch dieser Erfolg hat eine jahrzehntelange Vorgeschichte, in der die mRNA-Technologie eher ein Stiefkind der medizinischen Forschung war – trotz ihres früh erkannten Potenzials.
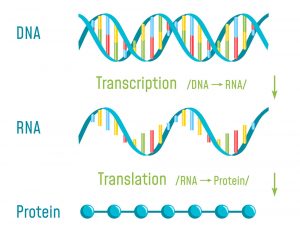
Bote zwischen DNA und Protein
Denn die enormen Einsatzmöglichkeiten von RNA-Wirkstoffen liegen schon lange auf der Hand. „Warum sind wir so überzeugt von der messenger-RNA?“, fragte Moderna-Präsident Stephen Hoge im April 2018 bei einer Investoren-Tagung. „Weil alles Leben, das wir kennen, erst durch messenger-RNA möglich wird. Mit unseren Worten ausgedrückt: mRNA ist die Software des Lebens.“
Tatsächlich ist diese einsträngige Ribonukleinsäure die Voraussetzung dafür, dass unsere Zellen Proteine herstellen können – und damit die Biomoleküle, auf der alle zellulären und körperlichen Aktivitäten beruhen. Die Rolle der mRNA für die Proteinproduktion erkannten Wissenschaftler schon Anfang der 1960er Jahren. Damals wiesen sie nach, dass die mRNA bei der Transkription des Erbguts im Zellkern entsteht. Beim Ablesen eines Gens wird die ursprünglich in der DNA kodierte Bauanleitung eines Proteins kopiert und in ein RNA-Stück umgeschrieben.
Die mRNa wandert nun in das Zellplasma zu den Ribosomen und wird dort im Prozess der Translation ausgelesen. Die zellulären Proteinfabriken setzen entsprechend der RNA-Bauanleitung verschiedene Aminosäuren nach und nach zum gewünschten Protein zusammen. In jeder unserer Zellen findet dieser Prozess tagtäglich in milliardenfacher Ausführung statt.