Woher genau „wissen“ die Proteine wie sie sich falten müssen, um ihre Funktion korrekt erfüllen zu können? Die Antwort darauf liefert ein biochemisches Grundprinzip. Dies besagt, dass alle Proteine eine Energieminimierung anstreben, also eine Faltung, die für das Protein energetisch besonders günstig ist. Wenn das Protein diesen Zustand der niedrigsten Energie gefunden hat, „weiß“ das Protein: Aha, so bin ich richtig gefaltet und kann meine Funktion erfüllen.
Levinthal-Paradox – Faltung ist nicht zufällig
Doch wie genau findet das Protein nun die Faltung, die am energetisch günstigsten ist? Ein Protein könnte natürlich alle möglichen Konformationen ausprobieren und würde dann irgendwann schon die richtige – also die energieniedrigste – Faltung finden. Doch das würde unendlich lange dauern, denn für ein Protein mit einer Länge von beispielsweise 150 Aminosäuren gäbe es 2150 Möglichkeiten sich zu falten.
Auch wenn eine Änderung der Konformation nur wenige Pikosekunden dauert, bräuchte das Protein über 1024 Jahre, um die korrekte Faltung zu finden. Tatsächlich findet ein Protein aber innerhalb von Minuten, zum Teil sogar Sekunden zur optimalen Faltung. Damit ist schonmal eindeutig klar, dass die Suche nach der korrekten Konformation nicht zufällig abläuft.
Umweltbedingungen begünstigen korrekte Faltung
Doch was ist dann die Triebkraft? Vereinfacht ausgedrückt: Die Aminosäuren in der Kette des Proteins folgen den gegebenen physikalischen Gesetzen und finden damit ihren Weg zur korrekten Faltung. Zu solchen Gesetzen gehört die Energieminimierung und das Streben nach einem energetisch günstigen Zustand. Auch der hydrophobe Effekt, der dafür sorgt, dass sich die hydrophoben Seitenketten im Inneren des Proteins zusammenlagern, trägt zur Energieminimierung bei.
Der hydrophobe Effekt sorgt außerdem für einen weiteren Schritt in Richtung Energieminimierung, weil die hydrophilen Aminosäuren jetzt auf der Oberfläche angeordnet sind. Nun können sie Interaktionen mit Wassermolekülen eingehen, was wiederum für eine Stabilisierung des Proteins sorgt. Und diese Stabilisierung ist energetisch günstig und damit ein weiterer Punkt auf der To-Do-Liste des Proteins auf dem Weg zur korrekten Faltung.
Physikalische und chemische Gesetze, die unter den gegebenen Umgebungsbedingungen einer Zelle herrschen, begünstigen also die korrekte Faltung und „lenken“ die Aminosäureketten in eine optimale Konformation.
Fehlfaltung – gefangen im lokalen Minimum
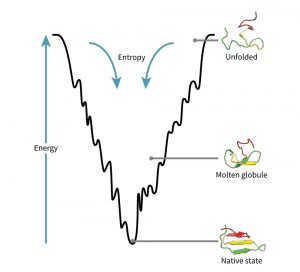
Der Weg eines Proteins zur Energieminimierung kann als eine Art Trichter betrachtet werden. Ganz oben ist das Protein noch ungefaltet und wenn es unten in der Trichterspitze angekommen ist, hat es seinen nativen, energetisch günstigsten Zustand erreicht. Doch die Wände des Trichters sind nicht glatt, sondern wellig. Die untere Spitze im Trichter ist also nicht das einzige Tal, sondern an den Wänden gibt es ganz viele kleine Täler, deren Wände auf dem Weg nach unten überwunden werden müssen.
Für diese Überwindung der kleinen Täler – in der Fachsprache lokale Minima genannt – muss etwas Energie aufgewandt werden. Die Überwindung dieser kleinen Täler ist jedoch entscheidend, um am globalen Energieminima, nämlich ganz unten im Trichter anzukommen.
Dort ist hat das Protein dann sein Ziel erreicht: den energetisch günstigen Zustand und damit die korrekte Faltung – es ist nun bereit für den Arbeitseinsatz in der Zelle. Allerdings bleiben manche Proteine auf der Strecke, sie sind sozusagen „gefangen“ in einem lokalen Minimum, weil sie die Talwand nicht überwinden können. Und das kann für die Zelle richtig gefährlich werden…