Manchmal kommt es vor, dass Proteine in ihrem Faltungsprozess stecken bleiben. Sie entwickeln dann eine Fehlfaltung, aus der sie nicht mehr herauskommen. Damit können sie sehr gefährlich für die Zelle und auch unseren ganzen Körper werden. Inzwischen gibt es sehr viele Krankheiten, deren Ursache auf falsch gefaltete Proteine zurückgeführt wird.
Mutationen als Urheber der Fehlfaltung
Auf dem Weg zur Faltung und damit zur Energieminimierung können Proteine in einem lokalen Minimum stecken bleiben, obwohl der tatsächliche Zustand der minimalen Energie noch gar nicht erreicht ist. Wenn so ein Fall zutrifft sind die Proteine meist erst halbgefaltet.
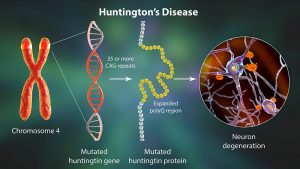
Die Gründe dafür, dass ein Protein im Faltungsprozess auf halbem Wege stecken bleibt und die korrekte Faltung nie erreicht, sind vielschichtig. Zum Beispiel können Genmutationen dazu führen, dass die Aminosäuresequenz der Proteine verändert wird und damit auch der Faltungsprozess, der zu anderen fehlerhaften Tertiärstrukturen führt als beim gesunden Protein.
Die teils extremen Auswirkungen solcher vereinzelten Mutationen demonstriert das Beispiel der Sichelzellanämie. Dabei wird die räumliche Struktur der roten Blutkörperchen nur aufgrund des Austauschs einer einzigen Aminosäure in ihrem Hauptprotein Hämoglobin so stark verändert, dass die roten Blutkörperchen von ihrer normalen runden Form zu einer sichelförmigen Erscheinung deformiert werden.
Faltungsfehler ohne Mutation
Trotz der sehr aufwendigen Qualitätskontrolle durch Chaperone entstehen aber auch immer wieder falsch gefaltete Proteine, die nicht auf Mutationen zurückgehen. Dabei sind vor allem komplexe Proteine mit mehreren Domänen betroffen. Ein Beispiel dafür ist die Augenkrankheit Grauer Star, bei der die hochkonzentrierte Proteinlösung in den Augenzellen aus dem Gleichgewicht gerät. Proteine die nun in pathologisch hoher Konzentration vorliegen, interagieren miteinander und verklumpen.
Ulrich Hartl vom Max-Planck-Institut für Biochemie bei München vermutet, dass Chaperone die pathologische Fehlfaltung nur verhindern können, wenn sie in ausreichend zellulärer Konzentration vorliegen. Vor allem im Alter seien unsere Chaperone weniger funktionstüchtig, was erklären könnte, warum manche neurodegenerativen Krankheiten erst mit hohem Alter auftreten.
Wie Verklumpungen krank machen können
Die Fehlfaltung von Proteinen kann dazu führen, dass sie nicht mehr ordnungsgemäß abgebaut werden können und stattdessen verkleben. Eine der Ursache dafür ist, dass die hydrophoben Seitenketten der Aminosäuren nicht säuberlich im Proteininnern verstaut sind, sondern nach außen ragen. Dadurch fördern sie eine Verklebung oder Verklumpung der Proteine.
Solche Aggregate können in Form von Oligomeren, ungeordneten Aggregaten oder amyloiden Fibrillen auftreten. Vor allem letztere sind besonders toxisch für die Zelle.
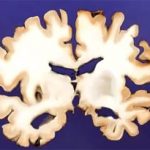
Aber was genau macht die Aggregate so gefährlich für unsere Zellen? Zum einen können die aggregierten Proteine nicht mehr ihre biologische Aufgaben in der Zelle erfüllen und stören somit die Zellabläufe. Vor allem aber können sich diese Aggregate in der Zelle ablagern. Diese Ablagerungen aus verklumptem Protein werden auch Plaques genannt und sind der Hauptgrund für neurodegenerative Krankheiten, wie Alzheimer, Parkinson oder Chorea Huntington, die immer mit einem großen Verlust an Nervenzellen im Gehirn einhergehen.
Bei der Alzheimer-Demenz beispielsweise lagern sich zwischen den Gehirnzellen Plaques des Proteins Beta-Amyloid und Fibrillen des Tau Proteins ab. Beide Aggregatablagerungen stören die Kommunikation zwischen den Nervenzellen im Gehirn und führen letztendlich zu einem Absterben der Neuronen.
Prione – ansteckende Proteine
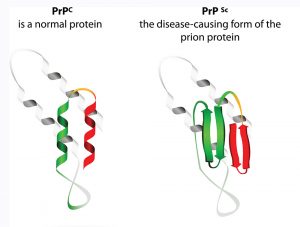
Ein weiteres Beispiel für ein falsch gefaltetes, pathogenes Protein sind die Prione, welche als infektiöse Proteine bezeichnet werden. Das klingt erstmal widersprüchlich, denn um infektiös zu sein, wie zum Beispiel Viren, ist ja eine Erbsubstanz nötig, die weitergegeben werden kann. Doch Prione sind Proteine und haben weder DNA noch RNA. Stattdessen geben sie ihre abnormale Faltung an umliegende Proteine weiter und bringen sie dazu, sich ebenfalls falsch zu falten. Die molekularen Mechanismen dieser „Ansteckung“ sind bis heute noch nicht verstanden.
Die falsch gefalteten Prionen vermehren sich im Gehirn von Mensch und Tier und lagern sich in Form von Plaques an den Nervenzellen ab. Die Gehirnzellen sterben dabei zuhauf ab und das Gehirngewebe wird regelrecht löchrig wie ein Schwamm. Deswegen wird die Prionen-Erkrankung Creutzfeldt-Jakob-Krankheit (CJK) auch als übertragbare spongiforme Enzephalopathie bezeichnet – „sponge“ ist englisch für Schwamm.
Die Krankheit ist bisher nicht heilbar, und auch deswegen so gefährlich, weil sich die Prionen vom Tier auf den Menschen übertragen können. Als Beispiel ist hier die Rinderwahn-Epidemie in Großbritannien zu nennen, von der auch Menschen betroffen waren, wenn sie mit Prionen infiziertes Rinderfleisch verzehrten.