Unsere Zellen erhalten unerwartete Krisenhilfe von den Mitochondrien – den „Kraftwerken der Zellen“. Denn diese können Zellstress in Form überschüssiger Elektronen quasi“ veratmen“. Dadurch helfen die Mitochondrien anderen Organellen in der Zelle, ihre Funktionen aufrechtzuerhalten. So beschützen sie auch den wichtigen Prozess der Proteinfaltung im Endoplasmatischen Retikulum.
Mitochondrien sind vor allem als „Kraftwerke der Zellen“ bekannt, denn sie stellen den chemischen Energieträger Adenosintriphosphat (ATP) im Prozess der mitochondriellen Atmung her. Diese Atmungskette wird auch als Elektronentransportkette bezeichnet, denn im Zuge ihrer Reaktionen geben Moleküle die negativen Ladungsträge ab oder nehmen sie auf.
Auch viele andere Systeme in der Zelle arbeiten mit solchen Redoxreaktionen. Dabei muss eine fein ausbalancierte Konzentration an Elektronen in jedem Kompartiment der Zelle herrschen, damit alles wie am Schnürchen läuft.
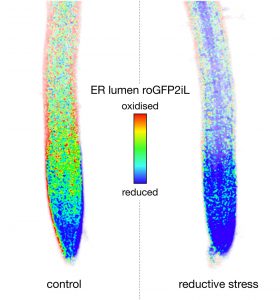
Reduktiver Stress in Pflanzen künstlich erhöht
Inwiefern genau nun die Mitochondrien dieses sogenannte Redox-Gleichgewicht im Endoplasmatischen Retikulum (ER) aufrechterhalten, haben Phillipe Fuchs von der Universität Münster und sein Team nun untersucht. Dafür analysierten sie die Auswirkungen von reduktivem Stress auf das Pflanzenwachstum der Pflanze Arabidopsis thaliana. Reduktiver Stress bedeutet hier, dass alle Reaktionspartner einer Redoxreaktion in der Zelle Elektronen aufgenommen haben und „gesättigt“ sind. Es gibt also einen Überschuss an Elektronen.
Der reduktive Stress in den Organellen der Pflanze wurde durch das Modellmolekül Dithiothreitol (DTT) künstlich herbeigeführt. DTT ist ein Thiol und damit ein Reduktionsmittel, welches andere Moleküle dazu bringt, Elektronen aufzunehmen, und damit den reduktiven Stress in der Zelle erhöht, weil es die Ab- und Aufnahme von Elektronen aus dem Gleichgewicht bringt.
Boost der mitochondrialen Atmungskette schützt das ER
Schon länger ist bekannt, dass Mitochondrien mit anderen Organellen kommunizieren können. So stehen zum Beispiel das Endoplasmatische Retikulum (ER) und die Mitochondrien über den ANAC017-Signalweg in Verbindung. Dabei löst sich ein in der ER-Membran sitzendes ANAC017-Protein und diffundiert in den Zellkern. Dort aktiviert es ein Gen, so dass daraufhin die Alternative Oxidase produziert wird. Dieses Enzym arbeitet im Mitochondrium als Beschleuniger der Atmungskette.
Fuchs und sein Team entdeckten nun, dass diese Kommunikation zwischen ER und Mitochondrium über reduktiven Stress, also eine Elektronenübersättigung, ausgelöst wird. Herrscht im ER reduktiver Stress, wird im Signalweg die Oxidase aktiviert, welche dafür sorgt, dass die mitochondriale Atmungskette viel mehr Elektronen aufnehmen kann. Durch Reaktion mit den Thiolen „veratmen“ die Mitochondrien sozusagen den Überschuss aus dem ER. „Die Beobachtung, dass Thiole als Elektronenquelle für die mitochondriale Atmung dienen, spricht stark für einen Austausch zwischen den beiden Redoxsystemen“, erläutern Fuchs und sein Team.
Mitochondrien sind flexibler als bisher gedacht
Dabei erfolgt die Herstellung des Redox-Gleichgewichts im ER durch die Mitochondrien schneller als bisher angenommen. „Besonders überraschend war nun die Beobachtung, dass Thiole tatsächlich in hoher Rate von pflanzlichen Mitochondrien veratmet und zur Energietransformation genutzt werden können“, erläutern Fuchs und sein Forschungsteam.
Dass Mitochondrien in Pflanzen besonders flexibel sind und spezielle Mechanismen besitzen, um Prozesse in anderen Zellorganellen zu unterstützen, ist seit vielen Jahren bekannt. Für die Wissenschaftler ist jedoch klar: „Die aktuelle Studie erweitert unser Verständnis von dieser Flexibilität entscheidend.“
Proteinfaltung im ER wird von Mitochondrien beschützt
Ein gesundes Maß an Thiolen und damit an Elektronen im ER ist besonders für die Proteinfaltung wichtig, erläutern Fuchs und seine Kollegen. Bei der Faltung eines Proteins im ER bilden sich sogenannte Disulfidbrücken zwischen den Schwefelatomen zweier Aminosäuren der Proteinkette aus. Die Bindung funktioniert aber nur, wenn die Schwefelatome oxidiert werden, also Elektronen abgeben.
Wenn nun aber im ER schon alle verfügbaren Moleküle Elektronen aufgenommen haben, fehlt die treibende Kraft für eine oxidative Reaktion und die Schwefelatome der Aminosäuren können ihre Elektronen nicht loswerden. Dies kann zu Fehlfaltungen der Proteine führen – und die können tödlich für die Zelle sein, da ein Protein seine Funktion in der Zelle ohne korrekte Faltung nicht ausführen kann.
Die Erkenntnis der Forschenden, dass Mitochondrien den reduktiven Stress im ER abmildern, identifiziert die Mitochondrien also als zusätzliche, indirekte Faltungshelfer. Denn durch das „Wegatmen“ der Elektronen im ER ermöglichen sie die Ausbildung von Disulfidbrücken und somit die korrekte Faltung der Proteine. (The Plant Cell, 2022; doi: 10.1093/plcell/koac017)
Quelle: Westfälische Wilhelms-Universität Münster