Viele Forschungsgruppen in aller Welt beschäftigen sich heute mit der Organokatalyse. Kein Wunder: Anders als die meisten Metallverbindungen sind Organokatalysatoren in der Regel einfacher, lassen sich prinzipiell aus nachhaltigen Rohstoffen herstellen, sind meistens günstiger im Preis und ungiftig.
Übergangsmetalle müssen dagegen häufig unter ökologisch schwierigen Bedingungen aus ohnehin begrenzten und zum Teil schwer zugänglichen Erzvorkommen gewonnen werden. Und im besten Fall sind auch die Reaktionsbedingungen moderat. Die Aldolreaktion mit Prolin etwa verläuft in wenigen Stunden bei Raumtemperatur. Gründe genug also, möglichst viele chemische Reaktionen mithilfe organischer Katalysatoren zu beschleunigen.
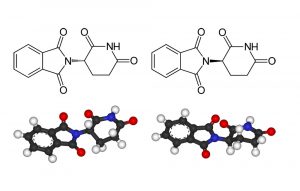
Warum „Spiegelbild“-Trennung wichtig ist
Dass sich diese prinzipiell auch für asymmetrische Katalysen eignen, hat die Forschung besonders beflügelt. Denn diese Reaktionen bereiten der Industrie häufig Kopfzerbrechen.
Gelingt eine Kontrolle der spiegelbildlichen Produkte einer Reaktion nicht, hat dies gleich zwei Nachteile. Zum einen reduziert es die Ausbeute des gewünschten Enantiomers, wenn ein Teil der Ausgangsstoffe zum unerwünschten Isomer reagiert. Zum anderen verursacht es Aufwand, Energie und Kosten, das gewünschte Enantiomer von seinem Spiegelbild abzutrennen. Hersteller sind also bestrebt, die Synthese möglichst selektiv zu gestalten.
Es gibt aber immer noch Fälle, in denen eine enantioselektive Synthese bisher gar nicht gelang und Hersteller geringere Ausbeuten und eine Enantiomeren-Trennung in Kauf nehmen müssen. Etliche Medikamente enthalten der Einfachheit halber das Racemat, also die Mischung beider Enantiomere. Das geht natürlich nur, wenn die unerwünschte Variante des Moleküls unschädlich ist.
Erfolgreiche Beispiele
Vor diesem Hintergrund können organische Katalysatoren durchaus neue Akzente setzen. So etwa bei der Synthese von Sitagliptin, einem Wirkstoff in Medikamenten zur Behandlung von Typ-2-Diabetes. Für den letzten Syntheseschritt, eine enantioselektive Hydrierung, gibt es seit einigen Jahren auch eine Lösung mit einem organischen Katalysator, einem sogenannten Dithiomalonat, der technische Herausforderungen beim Einsatz der früher üblichen Metallkatalysatoren vermeidet.
Ein weiteres Beispiel ist die Reaktion von Blausäure mit 2-Butanon, die zu einer wichtigen Vorstufe einiger Arzneimittelwirkstoffe führt. Lange Zeit gab es keine nennenswert enantioselektive Route. Im Jahr 2022 publizierte Benjamin List mit seinem Team erstmals eine organische Katalyse mit hoher Enantioselektivität. Das Katalysatormolekül ist deutlich größer und komplexer als Prolin. „Das ist inzwischen üblich“, erklärt List, „und liegt unter anderem daran, dass wir damit eine stärkere räumliche Kontrolle auf Reaktionen gewinnen.“
Außerdem würden heutige Katalysatormoleküle gezielt so designt, dass sie deutlich effektiver wirken, man also weniger von ihnen benötigt. Musste man Prolin für die Aldolreaktion noch in Konzentrationen von mehr als 20 Prozent den Reaktionspartnern beimischen, genügen bei vielen modernen Organokatalysatoren weniger als ein Prozent, zum Teil sogar deutlich weniger.
„Zauberstab der Chemie“
Dass im Extremfall ein einziges Katalysator-Molekül ausreicht, um damit Produkte im Tonnenmaßstab herzustellen, ist für Benjamin List gerade das Faszinierende an seinem Arbeitsgebiet. Er spricht auch gerne von „magischen Molekülen“, weil man sie durchaus mit „dem Zauberstab“ eines Magiers vergleichen könne. „Der Zauberer verwandelt Gegenstände damit, wir Chemiker wandeln Moleküle um“, so List.







