Dem Tod entrissen: US-Mediziner haben die Organe und Gewebe eines toten Schweins reanimiert und die für den Tod typischen Abbauprozesse gestoppt. Selbst nach einer Stunde unbehandelten Totseins ließen sich dadurch Durchblutung, Kontraktion der Herzmuskelzellen und viele Zellprozesse ohne die sonst typischen Schäden wiederherstellen, wie das Team in „Nature“ berichtet. Möglich wurde dies, weil eine Herz-Lungen-Maschine eine spezielle Flüssigkeit durch den Körper pumpte, die dem todestypischen Abbau entgegenwirkte.
Bisher gilt der Tod als unwiderruflich: Schon wenige Minuten nach dem Herzstillstand beginnt im Gehirn und Körper eine scheinbar unumkehrbare Kaskade der Abbauprozesse. Durch den Mangel an Sauerstoff und Nährstoffen kommt es dabei zu Veränderungen der Zellprozesse und Genaktivität, die zu fortschreitenden Schäden und dem Zelltod führen. Dieser Abbau setzt zwar je nach Zelltyp, Gewebe und Organ unterschiedlich schnell ein, lässt sich aber bisher kaum rückgängig machen – so jedenfalls dachte man lange.
Doch im Jahr 2019 widerlegten Wissenschaftler der Yale University unter Leitung von Nenad Sestan diese Annahme: Es war ihnen gelungen, die Gehirne toter Schweine zumindest in Teilen zu reanimieren. Obwohl die Behandlung mit dem speziellen Perfusionssystem erst vier Stunden nach dem Tod der Tiere begann, stoppte sie den Zelltod und stellte sogar in Teilen die Zellaktivität wieder her.
Spezielle Perfusionsflüssigkeit statt Blut
Jetzt ist den Forschenden der nächste Schritt gelungen: Sie haben ihr System auf den gesamten Körper ausgeweitet – und Zellen und Organe eines kompletten toten Schweins regeneriert. „Wenn wir bestimmte Zellfunktionen im toten Gehirn wiederherstellen können – einem Organ, das besonders anfällig für Sauerstoffmangel ist, dann sollte Ähnliches auch bei anderen lebenswichtigen Organen möglich sein“, sagt Teamleiter Sestan.
Basis des OrganEx getauften Systems ist eine Art Herz-Lungen-Maschine. Diese pumpt aber nicht das eigene, extern mit Sauerstoff angereicherte Blut in den Körper, sondern eine 1:1-Mischung aus Eigenblut und einer speziellen Perfusionsflüssigkeit. Diese enthält synthetisches Hämoglobin, das den Sauerstofftransport übernimmt, sowie Wirkstoffe, die Entzündungen und Zellschäden hemmen, Blutgerinnseln vorbeugen und das zelluläre Selbstmordprogramm stoppen sollen.
Organschäden und Gefäßkollaps trotz ECMO
Für das Experiment wurden Schweine zunächst betäubt und dann durch einen elektrischen Herzschock getötet. Die Kadaver ließen die Forschenden dann eine Stunde bei Zimmertemperatur unbehandelt liegen. Erst dann wurde ein Teil der Tiere an eine normale Herz-Lungen-Maschine (ECMO) angeschlossen, ein anderer Teil an das OrganEx-System. Diese künstliche Durchblutung wurde dann sechs Stunden aufrechterhalten, während die Wissenschaftler die Veränderungen in Organen, Blutgefäßen und Zellen untersuchten.
Es zeigte sich: Eine Stunde nach dem Tod hatten in vielen Zellen und Geweben schon Abbauprozesse eingesetzt, die durch die normale ECMO nicht mehr behoben werden konnten: Membranen und Blutgefäße wurden durchlässig oder kollabierten, dadurch konnte die Herz-Lungen-Maschine mehrere Organe des Schweins nicht mehr mit Blut versorgen. Selbst die großen Arterien von Nieren, Leber und Gehirn waren kaum mehr durchlässig, wie das Team berichtet. Die Zellen vieler Gewebe hatten zudem ihre Form und Genaktivität verändert und produzierten vermehrt Signalstoffe, die den zellulären Selbstmord einleiten.
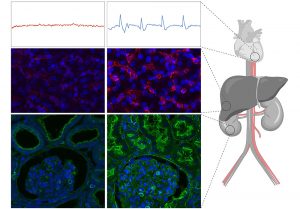
OrganEx stellt Kreislauf und Herzschlag wieder her
Anders bei OrganEx: Obwohl die Schweine schon seit einer Stunde tot waren, stellte das System den Kreislauf wieder her. Messungen ergaben, dass der gesamte Körper des toten Schweins durch die Perfusion mit ausreichend Sauerstoff versorgt wurde. Selbst feine Äderchen in der Niere waren durchlässig und ermöglichten die Versorgung des Organs mit Sauerstoff und Nährstoffen. Die Forschenden führen dies unter anderem darauf zurück, dass das künstliche Hämoglobin besser durch verengte Adern fließen kann als die weit größeren Roten Blutkörperchen.
Während die klassische ECMO weder Leichenstarre noch Leichenflecken verhindern konnte, blieben diese typischen Todesanzeichen bei dem OrganEx-System aus. In Teilen konnte das System sogar bereits eingetretene Todesfolgen wieder rückgängig machen: Im Herzmuskel begannen Zellen wieder zu kontrahieren und es trat wieder eine Art Herzschlag auf. Auch im Gehirn ließ sich bei einigen Zellen eine elektrische Aktivität nachweisen.
Regenerierte Zell- und Gewebefunktionen
Auch in den Geweben und Zellen stoppte das System die todestypischen Abbaukaskaden: „Damit verknüpft war eine Stabilisierung des Gewebestoffwechsels und eine Korrektur des physiologischen Ungleichgewichts, das durch einen länger anhaltenden Stopp der Durchblutung eintritt“, berichten Sestan und sein Team. Der Zustand der Zellen und Gewebe war auch unter dem Mikroskop kaum von dem bei einem gerade erst getöteten Schwein zu unterscheiden.
Genanalysen ergaben zudem, dass das OrganEx-System den zellulären Abbau selbst auf der Ebene der Genaktivität rückgängig machte. „Die Vergleiche enthüllten eine signifikante Aktivierung von Gensätzen für die DNA-Reparatur, den ATP-Stoffwechsel und den Aufbau des Zytoskeletts“, berichten Sestan und sein Team. Auch die Gene und Signalstoffe, die den Zelltod anstoßen, wurden von den in der Perfusorflüssigkeit enthaltenen Wirkstoffen unterdrückt.
Großes Potenzial für Klinik und Transplantation
Nach Ansicht des Forschungsteams eröffnet das OrganEx-System damit neue Möglichkeiten, beispielsweise Spenderorgane länger funktionsfähig zu halten. Aber auch bei der Behandlung von Patienten, die eine künstliche Sauerstoffversorgung über eine Herz-Lungen-Maschine benötigen, könnte die neuartige Perfusions-Flüssigkeit Vorteile bringen. Allerdings müsse das System vorher erst noch weiter auf Langzeitfolgen hin getestet werden, betonen Sestan und seine Kollegen.
Potenzial sehen auch nicht an der Studie beteiligte Wissenschaftler: „Dieses System und die damit gewonnen Erkenntnisse haben großes Potenzial für einen vielfältigen klinischen Einsatz“, kommentiert Uta Dahmen, Leiterin der Experimentellen Transplantationschirurgie am Universitätsklinikum Jena. „In der Transplantationsmedizin ist ein Einsatz zur Verbesserung von vorgeschädigten Organen vor der Transplantation denkbar. Ebenso denkbar ist der Einsatz nach einer temporären Minderdurchblutung von Organen wie nach einem Herzinfarkt.“
Allerdings betont auch sie: „Es bleibt ein weiter Weg von einer vielversprechenden experimentellen Studie zum routinemäßigen klinischen Einsatz eines neuen Medizinprodukts.“ (Nature, 2022; doi: 10.1038/s41586-022-05016-1)
Quelle: Yale University