Wegbereiter zu „grünem“ Wasserstoff? Forscher haben eine neue Methode gefunden, um Wasserstoff aus Ammoniak zu gewinnen – nur mithilfe von LED-Licht, Eisen und Kupfer. Anders als bei der gängigen Ammoniak-Spaltung benötigt diese Photokatalyse keine starke Hitze oder teure Platinmetalle, wie das Team in „Science“ berichtet. Das könnte den künftigen Einsatz von Ammoniak als Transport- und Speichermedium für „grünen“ Wasserstoff deutlich erleichtern.
Wasserstoff gilt als Energieträger der Zukunft. Er kann klimafreundlich durch Elektrolyse von Wasser mithilfe von Sonnen- und Windstrom gewonnen werden und dabei zugleich Stromschwankungen ausgleichen. Doch um den Wasserstoff effizient speichern und transportieren zu können, muss er extrem heruntergekühlt und verflüssigt oder aber in chemisch gebundene Form gebracht werden. Als vielversprechender Kandidat für letzteres gilt flüssiges Ammoniak (NH3), das zwar korrosiv und giftig ist, aber nur auf minus 40 Grad gekühlt werden muss.
Das Problem jedoch: Um Ammoniak wieder in Stickstoff und Wasserstoff aufzuspalten, benötigt man 400 bis 600 Grad Hitze und entsprechende Energie. Zwar können Katalysatoren aus Platin, Ruthenium, Ruthenium oder Palladium die Reaktionstemperatur senken, sie sind aber teuer und rar.
Eisen und Kupfer als Spaltungshelfer
Eine günstigere Alternative haben nun Yigao Yuan von der Rice University on Houston und seine Kollegen entwickelt. Statt das Ammoniak durch die klassische thermische Reaktion zu cracken, nutzen sie sogenannte plasmonische Photokatalysatoren. Diese meist aus metallischen Nanopartikeln bestehenden Reaktionshelfer wirken wie winzige Antennen, die die Energie des einfallenden Lichts bündeln und dadurch Elektronen des Materials kurzzeitig stark anregen. Ein zweites Metall dient als vorübergehender Partner für Stickstoff und ermöglicht so die Abspaltung des Wasserstoffs.
Für ihre Studie erzeugten die Forschenden zunächst einen Photokatalysator mit Kupfer als Lichtantenne und Eisen als chemischen Spaltungshelfer. Diese Partikel gaben sie zusammen mit Ammoniak in einen Testreaktor und führten in einem ersten Durchgang Licht in Form von Laserpulsen zu. Tatsächlich kam eine Ammoniakspaltung in Gang. „Unter Lichtzufuhr zeigte der Kupfer-Eisen-Katalysator eine Reaktivität und Effizienz, die mit der des gängigen Katalysators Kupfer-Ruthenium vergleichbar ist“, berichtet Yuans Kollege Hossein Robatjazi.
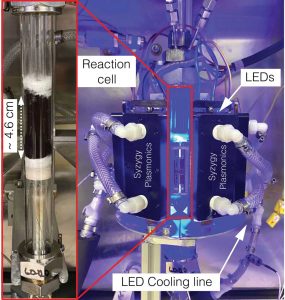
Lichtreaktor mit LED-Beleuchtung
Doch funktioniert dies auch in größerem Maßstab – und ohne aufwendige Lasertechnologie? Um das zu testen, verwendete das Forschungsteam nun einen 500-fach größeren Reaktor, dessen Lichtquelle aus einem dichten Array von LEDs der Wellenlänge 470 Nanometer bestand. Das Ammoniak wurde durch zwei Reaktionsröhren kontinuierlich am Katalysator vorbei durch den mit insgesamt 140 Watt beleuchteten Reaktor geleitet.
Das Ergebnis: „Der Kupfer-Eisen-Katalysator zeigt auch unter LED-Beleuchtung eine sehr hohe photokatalytische Reaktivität, mit einer 72-prozentigen Ammoniak-Umwandlung und einer Ausbeute von 14 Gramm Wasserstoff pro Tag“, berichtet das Team. Bei erhöhtem Durchfluss von Ammoniak ließ sich die Wasserstoffproduktion auf 18 Gramm pro Tag steigern. Diese Ammoniakspaltung fand allein mit der Energie der LEDs und bei Raumtemperatur statt, ohne zusätzliches Aufheizen.
„Dies ist der erste Bericht in der Fachliteratur, der zeigt, dass sich Wasserstoffgas in Grammmengen auch durch eine Photokatalyse mit LEDs aus Ammoniak gewinnen lässt“, sagt Seniorautorin Naomi Halas von der Rice University. Noch benötigt dieses Verfahren zwar mehr Strom als gängige Ammoniak-Cracker. Das Team erwartet aber, dass der Energieaufwand mit weiterer Optimierung und Skalierung bis auf wenige Kilowattstunden pro Kilogramm Wasserstoff sinken wird.
Grüner Wasserstoff – dezentral und günstig
Nach Ansicht der Wissenschaftler eröffnet dieses Verfahren damit neue Möglichkeiten, die Ammoniakspaltung günstiger und dezentraler zu mache. Denn statt in großen Cracker-Anlagen könnte der Wasserstoff auch in vielen kleinen, einfacheren Reaktoren aus dem Ammoniak wiedergewonnen werden. „Unsere Entdeckung ebnet den Weg zu nachhaltigem, kostengünstigem Wasserstoff, der lokal statt in zentralisierten Anlagen produziert wird“, sagt Halas‘ Kollege Peter Nordlander.
„Wasserstoff kann nur dann zum sauberen Brennstoff werden, wenn er günstig, einfach zu speichern und wiederzugewinnen ist“, ergänzt Halas. „Mit unserem Ansatz nähern wir uns diesem Ziel, indem wir Wasserstoff nach Bedarf und mithilfe von reichlich verfügbaren Materialien und Leuchtdioden aus einem Speichermedium wiedergewinnen können.“ (Science, 2022; doi: 10.1126/science.abn5636)
Quelle: Science, Rice University, Princeton University














