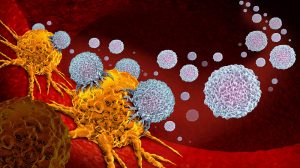
T-Zellen sind wichtige Akteure der zellulären Immunabwehr – auch gegen Krebs. Denn ähnlich wie Antikörper verfügen sie über die Fähigkeit, krankhaft veränderte Zellen erkennen und gezielt anzugreifen. Mobilisiert werden sie, indem ihnen eine Antigen-präsentierende Zelle das „feindliche“ Erkennungsmerkmal gezeigt hat und so die T-Zell-Rezeptoren aktiviert. Dies setzt in der T-Zelle eine Reaktionskaskade in Gang, durch die sie die Krebszellen erkennen und mithilfe von zytotoxischen Botenstoffen abtöten kann.
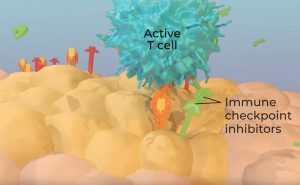
Checkpoints: Regulatoren gegen überschießende T-Zell-Aktivität
Damit T-Zellen nicht überaktiv werden und es zu einer überschießenden Immunreaktion und Autoimmunreaktionen kommt, tragen die T-Zellen auf ihrer Oberfläche auch hemmende Rezeptoren. Diese „Checkpoint-Moleküle“, darunter CTLA4 und PD1, fungieren als sich ergänzende Regulatoren für die T-Zell-Immunreaktion. „CTLA4 übt seinen regulatorischen Effekt vor allem in den Organen des Lymphsystems aus, während PD1 die T-Zell-Aktivität lokal in den peripheren Geweben hemmt“, erklärt Alex Waldmann von den US National Institutes of Health (NIH).
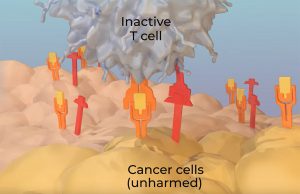
Das Problem jedoch: Krebszellen nutzen die Präsenz dieser Immun-Checkpoints aus: Viele von ihnen produzieren Botenstoffe und Oberflächenproteine, die an diesen hemmenden Rezeptoren ansetzen und so die T-Zellen außer Kraft setzen. Sie verpassen den Abwehrzellen einen Maulkorb.
Antikörper gegen die T-Zell-Blockade
An diesem Punkt setzt die Immuntherapie mittels Checkpoint-Inhibitoren an: In den 1990er Jahren entdeckten unabhängig voneinander zwei Forschungsteams in den USA und Japan, dass sich die beiden Checkpoints CTLA-4 und PD-1 durch Antikörper blockieren lassen. James Allison entwickelte den gegen CTLA-4 gerichteten Antikörper Ipilimumab und testete seine Wirksamkeit bei Mäusen und Menschen mit fortgeschrittenem Schwarzem Hautkrebs – mit Erfolg. Ipilimumab wurde 2011 in den USA und später auch in Europa zur Therapie von metastasierten Melanomen zugelassen.